Что такое возбудимость клетки: 7. Возбудимость клеток и тканей. Методы возбуждения. Закон «все или ничего».
Физиология возбудимых тканей : Farmf
1. Как называется биологическая система отдельного живого существа?
– личность
– генотип
– фенотип
+ организм
– ткань
2. Какие принципы лежат в основе надежности биологических систем?
– принцип ослабления
+ принцип взаимозаменяемости
+ принцип дублирования
+ принцип избыточности
– принцип взаимоисключаемости
3. Для чего необходима регуляция физиологических функций в организме?
+ активное управление деятельностью органов
+ приспособление к меняющимся условиям внешней среды
+ поддержание гомеостаза
+ обеспечение поведенческих реакций
+ поддержание определенной структуры
4. На каких уровнях возможна регуляция функций в организме?
+ субклеточный
+ клеточный
+ органный
+ организменный
+ поведенческий
5. Какие ткани обладают раздражимостью?
Какие ткани обладают раздражимостью?
+ эпителиальная
+ соединительная
+ мышечная
+ нервная
+ костная
6. Какие ткани обладают возбудимостью?
– костная
+ мышечная
– соединительная
+ нервная
7. Что характерно для нервной регуляции функций в организме?
+ высокая скорость воздействия
– малая скорость воздействия
+ краткосрочность воздействия
– инертность регуляции
– регулирует медленные процессы
8. Что характерно для рефлекторной регуляции функций в организме?
– малая скорость воздействия
+ большая скорость воздействия
+ краткосрочность воздействия
– регулирует медленные процессы
– инертность регуляции
9. Что характерно для гуморальной регуляции функций в организме?
+ малая скорость воздействия
– большая скорость воздействия
– краткосрочность воздействия
+ инертность регуляции
+ регулирует медленные процессы
10. Как называется специфическая деятельность системы или органа?
Как называется специфическая деятельность системы или органа?
– седиментация
+ функция
– адаптация
– агрегация
11. Что является главным фактором образования функциональной системы?
– деятельность внутренних органов
+ конечный результат действия
– условный рефлекс
– гуморальные влияния
– инстинкт
12. Какова основная причина формирования любой функциональной системы?
– инстинкты
– условные рефлексы
– потребность в торможении любой деятельности
+ потребность в конкретном результате действия
– мотивации
13. Что характерно для любой функциональной системы?
+ является многокомпонентной
– фиксированное объединение структур
+ временное объединение различных уровней
+ формируется для достижения полезного приспособительного результата
+ объединяет различные механизмы регуляции
14. Как называется совокупность физиологических механизмов, поддерживающих константы организма на определенном уровне?
Как называется совокупность физиологических механизмов, поддерживающих константы организма на определенном уровне?
– гистерезис
– гемостаз
– рефлекс
+ гомеостаз
15. В каких случаях транспорт через мембраны клеток будет пассивным?
– вход ионов калия в покое
+ выход ионов калия при возбуждении
+ вход ионов натрия при возбуждении
– выход ионов натрия в покое
– выход ионов натрия при возбуждении
16. Что понимают йод активным транспортом через мембраны клеток возбудимых тканей?
+ вход ионов калия в клетку в состоянии покоя
+ выход ионов натрия в состоянии покоя
– выход ионов калия из клетки в покое
– вход ионов натрия при возбуждении
+ транспорт ионов против градиента концентрации с затратой энергии
17. Какие функции выполняют белки, входящие в состав клеточных мембран?
+ рецепторная
– секреторная
+ формируют ионоселективные каналы
+ ферментативная
+ транспортная
+ выполняют роль хеморецепторов
18. Из каких функциональных частей состоит ионоселективиый канал мембран клеток?
Из каких функциональных частей состоит ионоселективиый канал мембран клеток?
– нексус
+ нора
+ селективный фильтр
+ воротный механизм
+ сенсор напряжения
19. Что характерно для биологических мембран?
+ состоят из двух слоев фосфолипидов
+ являются функционально активными системами
– являются пассивными структурами
+ содержат макромолекулы белков
+ снаружи покрыта мукополисахаридами
20. Какие функции выполняют белки, входящие в состав клеточных мембран?
+ формируют ионоселективные каналы
– секретирует фосфолипиды
+ являются ферментами
– инактивируют углеводы
21. Что характерно для калий-натриевой АТФазм клеточных мембран?
– обеспечивает пассивный транспорт ионов
+ обеспечивают активный транспорт ионов
– функционирует без затрат энергии
+ использует энергию макроэргических соединений
– работает без затрат энергии
+ работает с затратой энергии
+ требует липидного окружения
– обеспечивает пассивный транспорт ионов.
+ является электрогенным насосом
22. Какие функции выполняют мембраны возбудимых клеток?
+ транспортную
+ рецепторную
+ метаболическую
+ образует цитоскелет клетки
– секреторную
23. В мембранах возбудимых клеток имеются ионоселективные каналы:
+ для ионов калия
+ для ионов натрия
+ для ионов кальция
– для ионов кадмия
– для ионов меди
24. Какие функции выполняет калий-иатриевая АТФ-аза клеточных мембран?
– закачивает в клетку ионы натрия
+ закачивает в клетку ионы калия
– удаляет из клетки ионы калия
+ удаляет из клетки ионы натрия
+ поддерживает величину мембранного потенциала
25. Какое вещество избирательно блокирует только калиевые ионоселективные каналы биологических мембран?
– тетродотоксин
+ тетраэтиламмоний
– новокаин
– холинэстераза
– норадреналин
26. Какое вещество избирательно блокирует только натриевые ионоселективнме каналы биологических мембран?
Какое вещество избирательно блокирует только натриевые ионоселективнме каналы биологических мембран?
– норадреналин
– тетраэтиламмоний
+ тетродотоксин
– новокаин
– холинэстераза
27. Какие факторы (вещества) стимулируют деятельность калий- натриевой АТФазы?
+ увеличение концентрации ионов калия снаружи клетки
– увеличение количества ионов калия в клетке
– увеличение количества ионов натрия в межклеточной жидкости
+ увеличение количества ионов натрия в протоплазме
28. Какое вещество избирательно блокирует работу калий- натриевой АТФазы?
– норадреыалин
– ацетилхолин
+ строфантин
– тетраэтиламмоний
– тетродотоксин
29. Какое вещество (лекарственный препарат) блокирует кальциевые каналы мембран кардиомиоцитов и клеток гладких мышц сосудов?
– новокаин
– тетраэтиламмоний
+ верапамил
– тетродотоксин
– строфантин
30. В каких мембранах имеется кальциевая АТФаза?
В каких мембранах имеется кальциевая АТФаза?
+ мембраны саркоплазматического ретикулума скелетных мышц
+ мембраны кардиомиоцитов
+ мембраны гладких мышц
+ мембраны нервных клеток
– мембрана овального окна
31.Какое вещество избирательно блокирует только калиевые каналы мембран нервных клеток?
– новокаин
– тетродотоксин
+ тетраэтиламмоний
– холинзстераза
– нпгаяпрня ими
32. Что характерно для мембранного потенциала покоя?
– внутреннее содержимое клетки заряжено положительно
+ внутреннее содержимое клетки заряжено отрицательно
– наружная часть мембраны заряжена отрицательно
+ наружная часть мембраны заряжена положительно
– отсутствие разности потенциалов на мембране
33. Каковы причины формирования потенциала покоя клеток возбудимых тканей?
+ избирательная проницаемость мембран для различных ионов
– отсутствие проницаемости мембран для ионов калия
+ высокая проницаемость мембран для ионов калия
+ наличие в мембране калий-натриевой АТФазы
– высокая проницаемость мембран для анионов
34. Какие ионы вносят основной вклад в формирование потенциала покоя разных клеток?
Какие ионы вносят основной вклад в формирование потенциала покоя разных клеток?
– ионы натрия
+ ионы калия
– ионы хлора
– ионы кадмия
– ионы магния
35. Как можно зарегистрировать потенциал покоя?
– внеклеточными электродами
+ внутриклеточными электродами
– по перепаду температуры снаружи и внутри клетки
– по уровню метаболических процессов
36. Как заряжена поверхность нервной клетки по отношению к протоплазме в состоянии покоя?
– электроотрицательно
– нейтрально
+ электроположительно
37. Как заряжена протоплазма мышечной клетки по отношению к внешнему содержимому?
– нейтрально
– электроположительно
+ электроотрицательно
38. В каких клетках возможно зарегистрировать потенциал покоя с помощью микроэлектродной техники?
+ рецепторные клетки
+ эпителиальные
+ нервные
+ гладкомышечные
+ клетки миокарда
39. Какие ионы вносят основной вклад в формирование потенциала покоя гладкомышечных клеток?
Какие ионы вносят основной вклад в формирование потенциала покоя гладкомышечных клеток?
– ионы натрия
+ ионы калия
– ионы кальция
– ионы хлора
– ионы кадмия
40. Какой величины потенциал покоя у глиальных клеток?
– 10 мВ
– 20 мВ
– 40 мВ
– 60 мВ
+ 90 мВ
41. Какие ионы вносят основной вклад в формирование потенциала покоя кардиомиоцитов?
+ ионы калия
– ионы натрия
– ионы кальция
– ионы хлора
– ионы кадмия
42. Какие черты характеризуют мембранный потенциал покоя?
+ зависит от концентрации ионов калия внутри клетки и снаружи
+ не меняется яри неизменном функциональном состоянии клетки
– не зависит от клеточного метаболизма
– обусловлен высокой проницаемостью клеточных мембран для ионов хлора
+ его величина зависит от работы калий-натриевой АТФазы
43. Какие факторы обусловливают формирование и поддержание мембранного потенциала покоя клеток?
+ избирательная проницаемость мембран для различных ионов
– наличие рецепторных белков в мембране сверхпороговые стимулы
– высокая проницаемость для ионов натрия
– работа калий-натриевой АТФазы
– наличие рецепторных белков в мембране
+ высокая проницаемость для ионов калия
– высокая проницаемость для ионов натрия
44. Каковы характеристики потенциала покоя?
Каковы характеристики потенциала покоя?
+ его можно зарегистрировать во всех клетках
– его можно зарегистрировать только в нервных клетках
+ для его поддержания и формирования необходима энергия
+ зависит от ионной проницаемости мембран
– способен распространяться по нервным волокнам
45. В каких клетках возможно зарегистрировать потенциал покоя?
+ клетки скелетных мышц
+ нервные клетки
+ клетки гладких мышц
+ клетки миокарда
+ эпителиальные клетки
46. Какие свойства характеризуют потенциал действия (ПД)?
+ генерация ПД подчиняется закону “все или ничего”
– амплитуда ПД зависит от силы раздражения
– возникает при допорошвых стимулах
+ возникает при действии пороговых стимулов
+ возникает при еверхпороговых стимулах
47. Какие черты характеризуют потенциал действия в нервных клетках?
+ возникает на пороговые и сверхпороговые стимулы
+ обладает способностью к самораспространению
– не подчиняется закону «все или ничего»
+ подчиняется закону «все или ничего»
– обусловлен поступлением в клетку ионов калия
48. Что характерно для местного (локального) возбуждения?
Что характерно для местного (локального) возбуждения?
– возникает на сверхпороговые стимулы
+ возникает только на допороговые стимулы
+ градуальная зависимость от силы раздражения
+ медленная деполяризация
+ на высоте возбуждения возбудимость повышена
49. Какая фаза потенциала действия мышечной клетки обусловлена значительным поступлением ионов внутрь клетки?
+ фаза деполяризации
– фаза реполяризации
– фаза гиперполяризации
– фаза следовых потенциалов
50. Что характерно для потенциала действия в мышечных клетках?
+ возникает на пороговые и сверхпороговые стимулы
+ подчиняется закону “все или ничего”
+ обладает способностью к самораспространению
– генерируется с затратой энергии
– способен суммироваться
51. Какие ионы вносят основной вклад в процесс генерации потенциала действия в нервных клетках?
– ионы калия
+ ионы натрия
– ионы кальция
– ионы магния
– ионы хлора
52. Что характерно для распространяющегося возбуждения (ПД)?
Что характерно для распространяющегося возбуждения (ПД)?
+ быстрая деполяризация
+ вызывает специфическую реакцию
– не вызывает специфической реакции
– на высоте возбуждения (пик ПД) возбудимость повышена
+ на высоте возбуждения возбудимость отсутствует
53. Какова максимальная величина (амплитуда) потенциала действия в аксонах нервных клеток при внутриклеточной регистрации?
– 20 мВ
– 40 мВ
– 60 мВ
– 80 мВ
+ 110 мВ
54. Каковы механизмы потенциала действия в возбудимых клетках?
– увеличение проницаемости для ионов калия в фазу деполяризации
+ увеличение проницаемости для ионов калия в фазу реполяризации
– увеличение проницаемости для ионов натрия в фазу реполяризации
+ увеличение проницаемости для ионов натрия в фазу деполяризации
– активация калий-натриевой АТФазы
55. Какая фаза потенциала действия обусловлена значительным потоком ионов калия из клетки во внеклеточную среду?
– фаза деполяризации
– фаза латентного периода
+ фаза реполяризации
– фаза начальной деполяризации
56. Что характерно для местного (локального) возбуждения?
Что характерно для местного (локального) возбуждения?
– ответ на пороговые раздражители
+ ответ на допороговые раздражители
+ градуальная зависимость от силы раздражения
+ медленная деполяризация
57. Какая фаза потенциала действия нервных клеток обусловлена значительным поступлением ионов натрия внутрь клетки?
– фаза гиперполяризации
– фаза быстрой рсполяризации
– фаза медленной реполяризации
+ фаза деполяризации
58. Что характерно для местного (локального) возбуждения?
– деполяризация мембраны в ответ на сверхпороговые стимулы
+ деполяризация мембраны в ответ на допороговые стимулы
+ амплитуда деполяризации не превышает 20 адВ
– амплитуда деполяризации составляет 110-120 мВ
+ градуальная зависимость от силы раздражения
59. Каких величин достигает амплитуда потенциала действия в нервных клетках?
+ 120 мВ
+ 110 мВ
– 90 мВ
– 50 мВ
– 20 мВ
60. Каких величин достигает амплитуда потенциала действия в клетках скелетных мышц?
Каких величин достигает амплитуда потенциала действия в клетках скелетных мышц?
– 50 мВ
– 90 мВ
+ 110 мВ
+ 120 мВ
– 200 мВ
61. Какова продолжительность потенциала действия в нервных клетках?
+ 1-2 мс
– 3-5 мс
-10-15 мс
– 30-60 мс
– более 100 мс
62. Какова продолжительность потенциала действия в клетках скелетных мышц?
-1-2 мс
+ 3-5 мс
-10-15 мс
– 20-50 мс
– более 100 мс
63. Что характерно для местного (локального) возбуждения?
– ответ на пороговые раздражители
+ ответ на допороговые раздражители
+ градуальная зависимость от силы раздражения
– подчиняется закону “все или ничего”
+ медленная деполяризация
64. Какова причина самораспространения потенциала действия?
– высокая проницаемость мембран для ионов калия
– работа калий-натриевой АТФазы
– наличие в мембране рецепторных белков
+ перезарядка мембраны
– блокада иоиоселективных каналов
65. Каковы механизмы влияния новокаина на мембраны нервных клеток?
Каковы механизмы влияния новокаина на мембраны нервных клеток?
– стимуляция калий-натриевой АТФазы
– блокада калий-натриевой АТФазы
– активация натриевых каналов
+ блокада калиевых каналов
+ блокада натриевых каналов
66. Что такое возбудимость ткани?
– способность к гиперемии
+ способность генерировать потенциал действия
– способность увеличивать осмотическое давление
+ способность отвечать на раздражение процессом возбуждения
– способность проводить возбуждение
67. В какой зависимости находятся порог раздражения и возбудимость?
– в прямой
+ в обратной
– зависимости нет
68. Какие параметры могут служить мерой дан оценки возбудимости клеток?
– величина овершута
– амплитуда потенциала действия
+ хронаксия
+ пороговый ток
+ разность между величиной потенциала покоя и уровнем критической деполяризации
69. Какой показатель характеризует лабильность возбудимой ткани?
Какой показатель характеризует лабильность возбудимой ткани?
– амплитуда потенциала действия
– хронаксия
– реобаза
+ максимальное число возбуждений (ПД) в секунду
– порог раздражения
70. Какие черты характерны для возбудимости?
– свойственна всем тканям
+ свойственна нервной и мышечной тканям
+ меняется при возбуждении
+ ее показателем является порог раздражения
71. Какие причины аккомодации возбудимых тканей при малой крутизне нарастания раздражающего стимула?
+ повышение порога раздражения
– снижение порога раздражения
+ инактивация натриевых каналов
– активация натриевых каналов
– увеличение проницаемости для ионов калия
72. В каком соотношении находятся порог раздражения и возбудимость ткани?
– в логарифмическом
– зависимости нет
– в прямом
+ в обратном
73. Какие явления характеризуют аккомодацию возбудимых тканей?
+ уменьшение проницаемости для ионов натрия
– увеличение проницаемости для ионов калия
+ снижение возбудимости
+ повышение пороха раздражения
– снижения порога раздражения
74. Какие фазы потенциала действия соответствуют состоянию абсолютной невозбудимости?
Какие фазы потенциала действия соответствуют состоянию абсолютной невозбудимости?
+ фаза деполяризации
+ начало фазы реполяризации
– фаза отрицательного следового потенциала
– фаза положительного следового потенциала
– фаза следовой деполяризации
75. В какую фазу потенциала действия отмечается полное отсутствие возбудимости (рефрактерности)?
+ фаза деполяризации
– фаза следовой деполяризации
– фаза следовой гиперполяризации
– фаза отрицательного следового потенциала
– фаза положительного следового потенциала
76. Какой показатель характеризует лабильность возбудимой ткани?
– амплитуда потенциала действия
– хронаксия
– реобаза
+ максимальное количество возбуждений (ПД) в секунду
– порог раздражения
77. Какие показатели характеризуют лабильность возбудимой ткани?
– амплитуда потенциала действия
– величина мембранного потенциала покоя
+ максимальное количество возбуждений (ПД) в секунду
+ продолжительность потенциала действия
– порог раздражения
78. Какие явления характеризуют аккомодацию тканей?
Какие явления характеризуют аккомодацию тканей?
+ повышение порога раздражения
+ снижение возбудимости
– снижение порога раздражения
– повышение возбудимости
79. Какова возбудимость нервной ткани в фазу следового положительного потенциала (следовой гиперполяризации)?
– отсутствует полностью
– нормальная
– супернормальная
+ субнормальная
80. Какова возбудимость нервной ткани в фазу следового отрицательного потенциала (следовая деполяризации)?
– нормальная
+ супернормальная
– субнормальная
– отсутствует полностью
81. Какие фазы потенциала действия соответствуют состоянию рефрактерности?
+ фаза быстрой деполяризации
+ начало фазы реполяризации
– фаза отрицательного следового потенциала
– фаза положительного следового потенциала
– фаза следовой гиперполяризации
82. Какие причины обусловливают лабильность возбудимой ткани?
Какие причины обусловливают лабильность возбудимой ткани?
– амплитуда потенциала действия
+ продолжительность потенциала действия
– высокий порог раздражения
+ длительность фазы рефрактерности
83. Какие ткани обладают возбудимостью?
– костная
– ткани внутренней среды
+ нервная
+ мышечная
– соединительная
84. В каком соотношении находятся сила и время раздражения?
– в синусоидальном
– в линейном
– в прямом
+ в обратном
85. Какой процесс возникает на мембране нервной клетки под анодом в момент замыкания электрической цени?
– деполяризация
+ гиперполяризация
– изменений нет
86. В какой момент действия постоянного тока на возбудимую ткань под анодом возникает импульс возбуждения?
– в момент замыкания электрической цепи
+ в момент размыкания электрической цепи
– в момент вхождения тока в ткань
87. Какой процесс возникает на мембране нервной клетки под анодом в момент замыкания электрической цени?
Какой процесс возникает на мембране нервной клетки под анодом в момент замыкания электрической цени?
– изменений нет
– деполяризация
+ гиперполяризация
– реполяризация
88. В какой момент действия электрического тока на возбудимую ткань под катодом возникает импульс возбуждения?
– в момент размыкания электрической цепи
– в момент выхода электротока из ткани
+ в момент замыкания электрической цепи
89. Какие процессы возникают под катодом в момент размыкания электрической цепи при длительном воздействии допорогового стимула?
+ реполяризация
– экзальтация анодическая
+ депрессия католическая
– увеличение возбудимости
+ снижение возбудимости
90. Какие процессы возникают под анодом в момент размыкания электрической цепи при длительном воздействии допорогового стимула?
– гиперполяризация
– депрессия католическая
+ экзальтация анодическая
+ увеличение возбудимости
– снижение возбудимости
91. Подчиняется ли закону “все или ничего” процесс местного (локального) возбуждения?
Подчиняется ли закону “все или ничего” процесс местного (локального) возбуждения?
+ не подчиняется
– подчиняется
92. Подчиняется ли закону “все дли ничего” процесс генерации потенциала действия?
+ подчиняется
– не подчиняется
93. Какие факты отражает полярный закон раздражения (Пфлюгер)?
– возбуждение возникает под анодом в момент замыкания электрической цепи
– возбуждение возникает под катодом в момент размыкания электрической цепи
+ возбуждение возникает под катодом в момент замыкания электрической цепи
+ возбуждение возникает под анодом в момент размыкания электрической цепи
94. Как называется наименьшее время, в течение которого ток в две реобазы должен действовать на ткань, чтобы вызвать возбуждение?
– полезное время
+ хронаксия
– порог раздражения
– аккомодация
– лабильность
95. Как называется наименьшее время, в течение которого должен действовать пороговый ток, чтобы вызвать максимальное возбуждение?
– порог
– реобаза
– хронаксия
+ полезное время
– бесполезное время
96. Какие изменения возникают под катодом в момент замыкания электрической цени?
Какие изменения возникают под катодом в момент замыкания электрической цени?
– гиперполяризация
+ деполяризация
+ повышение возбудимости
– снижение возбудимости
– католическая депрессия
97. Какие изменения возникают под катодом в момент размыкания электрической цени?
+ реполяризация
– гиперполяризация
– деполяризация
– повышение возбудимости
+ снижение возбудимости
98. Какие изменения возникают под анодом в момент замыкания электрической цепи?
– деполяризация
+ гиперполяризация
+ снижение возбудимости
– повышение возбудимости
– анодическая экзальтация
99. Какие изменения возникают под анодом в момент размыкания электрической цепи?
– снижение возбудимости
+ повышение возбудимости
+ снижение порога раздражения
+ анодическая экзальтация
– гиперполяризация
100. Подчиняется ли закону “все или ничего” процесс распространяющегося возбуждения?
Подчиняется ли закону “все или ничего” процесс распространяющегося возбуждения?
+ подчиняется
– подчиняется
– только при условии допороговой стимуляции
101. Какие показатели можно использовать для оценки возбудимости мышц?
+ реобаза
+ хронаксия
+ порог раздражения
+ уровень критической деполяризации
– скорость проведения возбуждения
102. Какова основная функция сенсорных рецепторов?
– преобразование процесса возбуждения в любой другой вид энергии
– генерация потенциалов действия
– проведение возбуждения к исполнительному органу
+ преобразование определенного вида энергии в энергию нервного возбуждения
103. Какая зависимость обнаруживается между силой раздражения и величиной рецепторного потенциала?
– обратнопропорциональная
+ логарифмическая
– прямопропорциональная
– зависимости нет
104. Какие из перечисленных рецепторов относятся к вторичночувствующим?
Какие из перечисленных рецепторов относятся к вторичночувствующим?
– тактильные
+ зрительные
+ слуховые
+ вестибулярные.
– проприоцепторы
105. Какими свойствами обладает рецепторный потенциал?
+ не подчиняется закону «все или ничего»
– способен распространяться по нервному волокну
+ способен суммироваться
– не способен суммироваться
+ не распространяется по нервному волокну
106. Какие свойства характерны для рецепторного потенциала?
+ зависит от силы раздражения
– не зависит от силы раздражителя
– распространяется по нервному волокну без затухания
+ способен суммироваться
– подчиняется закону “все или ничего”
107. Какие свойства характерны для рецепторного потенциала?
+ зависит от силы стимула
+ способен к суммации
– распространяется по нервному волокну без затухания
+ не распространяется но нервному волокну
+ не подчиняется закону “все или ничего”
108. Какая зависимость обнаруживается между силой раздражения и величиной рецепторного потенциала?
Какая зависимость обнаруживается между силой раздражения и величиной рецепторного потенциала?
– зависимости нет
– степенная обратная
+ логарифмическая
– прямопропорциональная
– обратнопропордиональная
109. Какие функции выполняют сенсорные рецепторы?
– восприятие любых раздражителей
+ восприятие адекватных раздражителей
+ перевод энергии стимула в энергию нервного возбуждения
– генерация потенциалов действия при возбуждении
– проведение возбуждения к нервной клетке
110. Что характерно для вторичночувствующих рецепторов?
– рецепторный потенциал вызывает появление ПД в афферентном волокне
+ рецепторный потенциал приводит к выделению медиатора из пресинаптической зоны рецепторной клетки
– рецепторный потенциал обусловливает возникновение ПД в рецепторной клетке
+ между рецепторной клеткой и афферентным волокном есть синапс
111. Какие функции выполняют сенсорные рецепторы?
Какие функции выполняют сенсорные рецепторы?
– проведение возбуждения к исполнительным органам
– генерация потенциалов действия
+ преобразование определенного вида энергии в энергию нервного возбуждения
+ восприятие адекватных раздражителей
– восприятие любых раздражителей
112. Какие черты характеризуют генераторный потенциал во вторичночувствующих рецепторах?
– распространяется по нервному волокну
+ возникает в ответ на действие медиатора
+ является возбуждающим постсинаптическим потенциалом
+ является местным (локальным) ответом
– возникает в рецепторной клетке
113. Какие рецепторы относятся к первичночувствующим?
+ проприорецеиторы
– рецепторы вкуса
– вестибулорецепторы
+ обонятельные
+ тактильные
114. Какая обнаруживается зависимость между силой адекватного стимула и величиной (амплитудой) генераторного потенциала в первичночувствующих рецепторах?
+ логарифмическая
– обратная
– прямая
– зависимости нет
115. Что характерно для генераторного потенциала во вторичночувствующих рецепторах?
Что характерно для генераторного потенциала во вторичночувствующих рецепторах?
+ вызывает появление потенциалов действия в афферентном волокне
+ зависит от количества медиатора, выделяемого рецепторной клеткой
+ является возбуждающим постсинаптическим потенциалом
– является рецепторным потенциалом
– приводит к выделению медиатора из рецепторной клетки
116. Что характерно для генераторного потенциала в первичночувствующих рецепторах?
– приводит к выделению медиатора из рецепторной клетки
– распространяется по нервному волокну
+ является рецепторным потенциалом
+ обусловливает появление потенциалов действия в афферентном волокне
+ зависит от силы раздражения
117. Какая зависимость между силой стимула и величиной генераторного потенциала во вторичночувствующих рецепторах?
– зависимости нет
– прямая
– обратная
– гиперболическая
+ логарифмическая
118. Какие рецепторы относятся к интерорецепторам?
Какие рецепторы относятся к интерорецепторам?
– слуховые
+ проприорецепторы скелетных мышц
– тактильные
– зрительные (палочки и колбочки)
+ осморецепторы гипоталамуса
119. Какие рецепторы относятся к экстерорецепторам?
+ слуховые
– проприорецепторы скелетных мышц
+ тактильные
+ зрительные (палочки и колбочки)
– осморецепторы гипоталамуса
120. Где происходит генерация потенциала действия эфферентных нервных клеток?
+ в области аксонного холмика
– в дендритах
– в местах перехода дендритов в тело нейрона
– в синапсах на теле нейрона
– в синапсах на дендритах
121. Какими свойствами обладают нервные клетки?
– сократимость
– аморфность
+ возбудимость
+ проводимость
+ раздражимость
122. Где возникают разряды эфферентных импульсов (ПД)?
– в дендритах
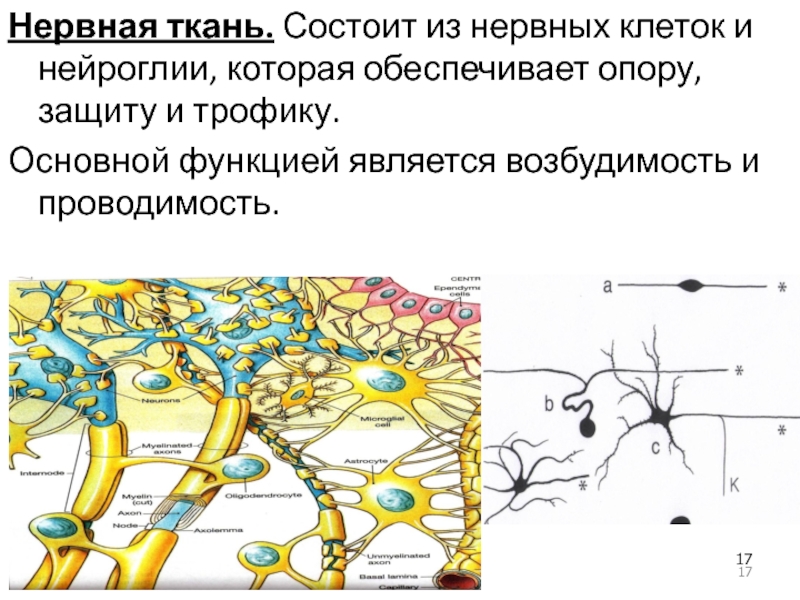
– в теле нервной клетки
– в области перехода дендритов в тело нейрона
+ в аксонном холмике
123. Какова основная функция астроцитов в нервной системе?
Какова основная функция астроцитов в нервной системе?
– защитная (фагоцитарная)
+ трофическая
– нейросекреторная
– проводниковая
124. Каковы особенности функционирования клеток нейроглии?
+ высокая чувствительность к ионным изменениям среды
+ высокая активность калий-натриевой АТФазы
– низкая активность калий-иатриевой АТФазы
+ на раздражение отвечает только медленной деполяризацией
– способны часто генерировать потенциалы действия
125. Какие функции выполняют нервные клетки?
– экскреторная
+ секреторная
+ восприятие информации
+ обработка информации
+ проведение возбуждения
126. Что характерно для вставочных нейронов?
– не способны проводить возбуждение
+ способны генерировать потенциалы действия
+ обеспечивают связь между афферентными и эфферентными нейронами
+ их больше, чем афферентных и эфферентных нейронов
– относятся к нейроглии
127. Где первоначально происходит генерация потенциалов действия в афферентных нейронах?
Где первоначально происходит генерация потенциалов действия в афферентных нейронах?
– в области аксонного холмика
– в последнем перехвате Ранвье на аксоне
+ в первом после рецептора перехвате Ранвье
– в теле нейрона
– в синапсе
128. Какие функции выполняют глиальные клетки?
+ опорная
+ трофическая
– обеспечивают репаративные функции
– генерируют потенциалы действия
+ участвуют в миелинизации аксонов нервных клеток
129. Что характерно для функционирования нервных клеток?
– не способны генерировать ПД
+ способны генерировать потенциалы действия
– не обладают проводимостью
+ способны проводить возбуждение
– не обладают возбудимостью
130. Что характерно для афферентных нервных клеток?
+ проводят возбуждение от рецепторов к нервным центрам
– проводят возбуждение от нервных центров к исполнительным органам
+ способны генерировать потенциалы действия
– не способны генерировать потенциалы действия
+ синтезируют медиатор
131. Что характерно для эфферентных нейронов?
Что характерно для эфферентных нейронов?
– проводят возбуждение от рецепторов к нервным центрам
+ проводят возбуждение от нервных центров к исполнительным органам
+ генерация потенциала действия в области аксонного холмика
– генерация ПД в любой части клетки
– являются вставочными нейронами
132. Какие свойства и функции характерны для глиальных клеток?
+ защитная (фагоцитарная)
+ опорная
+ образуют миелиновые оболочки
+ высокочувствительны к ионным изменениям среды
– проводят возбуждение
133. Что характерно для эфферентных нервных клеток?
+ способны генерировать потенциалы действия
+ синтез медиатора
– не способны генерировать потенциалы действия
– проводят возбуждение к нервным центрам от рецепторов
+ проводят возбуждение от нервных центров к исполнительным органам
134. Какие функции выполняют нервные клетки?
+ восприятие информации
+ проведение возбуждения
– экскреция
+ секреция
+ обработка (кодирование) информации
135. Что характерно для быстрого аксонного транспорта веществ?
Что характерно для быстрого аксонного транспорта веществ?
+ транспортируются белковые частицы
– зависит от диаметра волокна
+ не зависит от диаметра волокна
– сопряжен с проведением возбуждения
+ не сопряжен с проведением возбуждения
136. Что характерно для медленного аксонного транспорта?
– сопряжен с проведением возбуждения
+ необходим в процессах роста и регенерации аксона
– достигает скорости 400 мм в сутки
+ скорость не превышает 4 мм в сутки
+ перемещение всей массы белков цитоплазмы
137. Чем характеризуются астроциты нейроглии?
– проводят возбуждение
– генерируют потенциалы действия
+ составляют почти 50 % серого вещества мозга
+ выполняют трофическую функцию
+ на раздражение отвечают только медленной деполяризацией
138. Каковы функции олигодендроцитов?
– проводят возбуждение
+ образуют миелин в нервной системе
+ поддерживают целостность миелиновых оболочек
– составляют основную массу серого вещества мозга
– являются глиальными макрофагами
139. Какие особенности характерны для клеток нейроглии?
Какие особенности характерны для клеток нейроглии?
+ выполняют опорную функцию
– проводят возбуждение
+ чувствительны к ионным изменениям микросреды
+ трофическая функция
– низкая активность калий-натриевой АТФазы
140. Каковы особенности вставочных нейронов в ЦНС?
– их меньше, чем других нейронов
+ их больше, чем других нейронов
+ могут генерировать до 1000 импульсов в секунду
– проводят возбуждение к нервным центрам
– проводят возбуждение к исполнительным органам
141. Что характерно для нервных волокон типа А-гамма?
– наибольшая скорость проведения возбуждения
+ скорость проведения не превышает 40 м в сек
+ являются эфферентными волокнами проприоцептеров (мышечных веретен)
– не имеют миелиновой оболочки
– скорость проведения не превышает 3 м/сек
142. Что характерно для нервных волокон типа А-сигма?
– наибольшая скорость проведения возбуждения
– наименьшая скорость проведения возбуждения
+ проводят возбуждение от рецепторов боли
– являются эфферентными волокнами скелетных мышц
– являются волокнами вегетативной нервной системы
143. Какие свойства характеризуют нервные волокна типа А-бета?
Какие свойства характеризуют нервные волокна типа А-бета?
– наименьшая скорость проведения возбуждения
– лишены миелиновой оболочки
+ проводят возбуждение от рецепторов давления и прикосновения
+ скорость проведения возбуждения 40-70 м/с
– являются эфферентными волокнами скелетных мышц
144. Какие отличительные черты характеризуют нервные волокна тина С?
+ наименьшая скорость проведения возбуждения
+ отсутствие миелиновой оболочки
+ афференты кожных рецепторов боли
+ являются эфферентными постганглионарными волокнами вегетативной нервной системы
+ афференты от рецепторов тепла
145. От каких факторов зависит скорость проведения возбуждения по нервному волокну?
– количество волокон в нерве
– сила раздражителя
– природа раздражителя
+ толщина (диаметр) нервного волокна
+ наличие перехватов Ранвье
146. Какие факторы влияют на скорость проведения возбуждения по нервному волокну?
– величина потенциала покоя
– сила раздражителя
+ диаметр осевого цилиндра нервного волокна
– природа раздражителя
+ наличие перехватов Ранвье
147. Что характерно для нервных волокон типа В?
Что характерно для нервных волокон типа В?
– скорость проведения возбуждения достигает 120 м/с
+ скорость проведения не превышает 14 м/с
– скорость проведения не превышает 3 м/с
+ являются миелинизированными волокнами
– лишены миелиновой оболочки
148. По каким нервным волокнам проводится возбуждение от проприорецепторов (мышечных веретен)?
– тип С
– тип В
– тип А-сигма
– тип А-бета
+ тип А-альфа
149. Какие особенности характеризуют нервные волокна типа С?
– наибольшая скорость проведения возбуждения
– наличие миелиновой оболочки
+ наименьшая скорость проведения возбуждения
– являются эфферентными волокнами скелетных мышц
+ являются афферентными волокнами рецепторов боли
150. Что характерно для проведения возбуждения миелинизированных нервных волокон?
– минимальная скорость проведения возбуждения
+ скорость может достигать 120 м/с
– возбуждением охватывается вся поверхность волокна
+ возбуждение возникает в перехвате Ранвье
+ возбуждение распространяется сальтаторно
151. Какие свойства характеризуют нервные волокна тина А – альфа?
Какие свойства характеризуют нервные волокна тина А – альфа?
+ наибольшая скорость проведения возбуждения
+ являются эфферентными волокнами скелетных мышц
+ являются афферентными волокнами от мышечных веретен (проприорецепторы)
– лишены миелиновой оболочки
– проводят возбуждение от рецепторов боли
152. Какие закономерности действительны для проведения возбуждения по нервному волокну?
– односторонность проведения
+ двусторонность проведения
+ низкая утомляемость
– высокая утомляемость
+ скорость проведения зависит от диаметра волокна и наличия миелиновой оболочки
153. От каких факторов зависит скорость проведения возбуждения по нервному волокну?
+ толщина осевого цилиндра
– количество волокон в нерве
– сила раздражителя
– природа раздражителя
+ наличие перехватов Ранвье
154. Что характерно для нервных волокон типа А-сигма?
+ проводят возбуждение от кожных рецепторов температуры
+ проводят возбуждение от рецепторов боли
– иннервируют скелетную мускулатуру
– являются афферентными волокнами мышечных веретен (проприорецепторов)
– обладают наибольшей скоростью проведения возбуждения
155. К какому типу относятся моторные нервные волокна, иннервирующие скелетную мускулатуру?
К какому типу относятся моторные нервные волокна, иннервирующие скелетную мускулатуру?
+ тип А-альфа
– тип А-бета
– тип А-сигма
– тип В
– тип С
156. С какой скоростью распространяется возбуждение по нервным волокнам типа А-альфа?
– 0,5-3 м/с
– 10 м/с
– 15-20 м/с
– 40-60 м/с
+70-120 м/с
157. С какой скоростью распространяется возбуждение по нервным волокнам типа А-бета?
– 80-120 м/с
+ 40-70 м/с
– 15-20 м/с
– 10 м/с
– менее 5 м/с
158. С какой скоростью распространяется возбуждение но нервным волокнам типа А-сигма?
– менее 3 м/с
+ 5-15 м/с
– 20-40 м/с
– 40-70 м/с
– более 70 м/с
159. С какой скоростью распространяется возбуждение по нервным волокнам типа В?
– 0,5-2 м/с
+ 3-15 м/с
– 15-40 м/с
– 40-70 м/с
– 70-120 м/с
160. С какой скоростью распространяется возбуждение по нервным волокнам типа С?
С какой скоростью распространяется возбуждение по нервным волокнам типа С?
+ менее 3 м/с
– более 120 м/с
– 70-120 м/с
– 40-70 м/с
– 10-15 м/с
161. Какие черты характеризуют особенности проведения возбуждения в синапсах?
– возбуждение передается электрическим путем
+ необходим медиатор
– двустороннее проведение возбуждения
+ одностороннее проведение возбуждения
+ наличие синаптической задержки
162. Какие черты характеризуют постсинаптические потенциалы?
– возникают самопроизвольно
+ возникают в ответ на выделение медиатора
– являются быстро распространяющимся возбуждением
+ являются локальным ответом
– их суммация невозможна
163. В каких синапсах используется медиатор гамма-аминомасляная кислота?
– нервно-мышечные
– возбуждающие синапсы ЦНС
– синапсы вегетативных ганглиев
+ тормозные синапсы ЦНС
– адренэргические синапсы вегетативной нервной системы
164. Что характерно для субсинаптической мембраны?
Что характерно для субсинаптической мембраны?
+ наличие специфических хеморецепторов
+ низкая чувствительность к действию электрического тока
– высокая чувствительность к действию электрического тока
+ возникновение локальных ответов
– высокая проницаемость для ионов натрия
165. Какими свойствами обладает субсинаптическая мембрана?
– слабая чувствительность к химическим раздражителям
– высокая чувствительность к электрическому току
+ высокая чувствительность к действию химических веществ
– способность генерировать потенциалы действия
+ очень низкая чувствительность к электротоку
166. Какова роль нейропептидов в синаптической передаче возбуждения?
+ модулирующая
– блокирующая
– шунтирующая
167. Какой медиатор обеспечивает передачу возбуждения в нервно- мышечных синапсах?
– норадреналин
– гистамин
– ГАМК
– глицин
+ ацетилхолин
168. В каких синапсах используется медиатор ацетилхолин?
В каких синапсах используется медиатор ацетилхолин?
+ нервно-мышечные
– адренэргические
+ синапсы вегетативных ганглиев парасимпатической нервной системы
+ синапсы вегетативных ганглиев симпатической нервной системы
169. Выделяется ли медиатор в синаптическую щель в состояний покоя?
– нет
– выделяется в больших количествах
+ выделяется в малых количествах (кванты)
– выделяется только при возбуждении нервного окончания
170. Каковы механизмы инактивации медиатора в синапсе?
– нейтрализация буферными системами крови
+ диффузия в лимфу или кровь
+ гидролиз ферментами
+ обратный захват пресинаптическими структурами
– фагоцитоз
171. Что характерно для синаптической передачи возбуждения?
+ одностороннее проведение
– двустороннее проведение
+ наличие синаптической задержки
+ низкая лабильность
– высокая лабильность
172. Чем обусловлен возбуждающий или тормозныё характер действия медиатора?
Чем обусловлен возбуждающий или тормозныё характер действия медиатора?
– количеством медиатора
– скоростью диффузии медиатора
– свойством медиатора
+ специфичностью рецепторов субсинаптической мембраны
173. Какие свойства характерны для синапсов?
+ одностороннее проведение возбуждения
– двустороннее проведение возбуждения
+ низкая лабильность
– низкая утомляемость
+ высокая утомляемость
174. Какие свойства характерны для синапсов?
+ отсутствие рефрактерности
+ возбуждение проводится в одном направлении
+ количество выделенного медиатора пропорционально частоте нервных импульсов
+ высокая чувствительность к химическим веществам
– двустороннее проведение возбуждения
175. Какое вещество способно блокировать холинэргические рецепторы нервно-мышечного синапса?
– новокаин
– тетродотоксин
– тетраэтиламмоний
+ кураре
– верапамил
176. В каких синапсах медиатором является ацетилхолин?
В каких синапсах медиатором является ацетилхолин?
+ синапсы скелетных мышц
+ синапсы вегетативных ганглиев
– синапсы симпатических постганглионарных волокон
+ синапсы парасимпатических нервов
177. В каких синапсах медиатором является ГАМК?
– нервно-мышечные синапсы
– синапсы вегетативных ганглиев
+ тормозные синапсы клеток Реншоу
– возбуждающие синапсы
– адренэргические синапсы
178. Какие факторы способствуют выделению медиатора в синапсах?
– гиперполяризация мембраны нервного волокна
+ возбуждение нервного волокна
+ поступление ионов кальция в нервное окончание
– возникновение возбуждающего постсинаптического потенциала
– возникновение тормозного постсинаптического потенциала
179. Какие процессы возникают на постсинаптической мембране тормозных синапсов?
– возбуждающий постсинаптический потенциал
– потенциал действия
+ гиперполяризация
– повышение возбудимости
180. Чем обусловлен тормозный или возбуждающий характер действия медиатора?
Чем обусловлен тормозный или возбуждающий характер действия медиатора?
– количество медиатора
– скорость диффузии
+ специфичность рецепторов субсинаптической мембраны
– свойством медиатора
– наличием ионоселективных каналов
181. Что такое изотоническое сокращение скелетной мышцы?
– сокращение автоматическое
– увеличение напряжения при неизменной длине
– увеличение напряжения при укорочении
+ укорочение мышцы без повышения тонуса
182. Что такое ауксотокическое сокращение мышцы?
– увеличение тонуса при неизменной длине
– уменьшение длины при неизменном тонусе
+ уменьшение длины и увеличение тонуса
– уменьшение длины и уменьшение тонуса
– увеличение длины и уменьшение тонуса
183. В каких режимах способны сокращаться скелетные мышцы?
+ изометрический
+ изотонический
+ ауксотонический
– изоволюмический
184. Какие черты характеризуют быстрые физические волокна с гликолитическим типом окисления скелетных мышц (белые мышцы)?
Какие черты характеризуют быстрые физические волокна с гликолитическим типом окисления скелетных мышц (белые мышцы)?
– малоутомляемы
+ быстро утомляются
– развивают небольшую силу
+ развивают большую силу при сокращении
+ могут выполнять кратковременную, но мощную работу
– могут выполнять долговременную, но слабую работу
185. Какие белки скелетных мышц принимают участие в реализации и активации сокращения?
+ актин
– миоглобин
+ миозин
+ тропонин
+ тропомиозин
186. С каким периодом одиночного мышечного сокращения скелетной мышцы совпадает по времени потенциал действия?
– период укорочения
+ латентный период
– период максимального укорочения
– период расслабления
– период восстановления
187. С каким белком взаимодействуют ионы кальция, активируя сокращение скелетной мышцы?
– миозин
+ тропонин
– тропомиозин
– актин
– кальмодулин
188. Что такое изометрическое сокращение скелетной мышцы?
Что такое изометрическое сокращение скелетной мышцы?
– укорочение мышцы при постоянном ее напряжении
+ увеличение напряжения при постоянной длине
– укорочение при сокращении
– напряжение при укорочении
189. В каких режимах способны сокращаться скелетные мышцы?
– изоволюмическнй
+ изометрический
+ изотонический
+ ауксотонический
– нротонатический
190. Какие черты характеризуют медленные физические волокна окислительного типа скелетных мышц (красные мышцы)?
– высокие пороги активации
+ низкие пороги активации
+ развивают небольшую силу сокращения
+ работают слабо, но долго
– работают сильно, но недолго
191. Что характерно для медленных физических волокон окислительного тина скелетных мышц (красные мышцы)?
+ низкие пороги активации
– высокие пороги активации
+ малая скорость сокращения
– большая скорость сокращения
+ малоутомляемы
– быстроутомляемы
192. Что характерно для быстрых физических волокон скелетных мышц с гликолитическим типом окисления (белые мышцы)?
Что характерно для быстрых физических волокон скелетных мышц с гликолитическим типом окисления (белые мышцы)?
– малоутомляемы
+ быстроутомляемы
– развивают небольшую силу
+ развивают большую силу
+ работают кратковременно, но мощно
– содержат очень мало миофибрилл
193. Что такое двигательная единица?
+ группа мышечных волокон, иннервируемая разветвлением одного аксона
– единица измерения мощности мышцы
– мышечная группа, выполняющая слитное сокращение
– мышечное волокно, иннервируемое несколькими нервными клетками
194. Какими свойствами обладают волокна скелетных мышц?
– пергюнтивность
+ возбудимость
+ проводимость
+ пластичность
195. Какие события происходят во время латентного периода одиночного сокращения скелетной мышцы?
– взаимодействие актина и миозина
+ возникновение распространяющегося возбуждения
– поступление ионов кальция в саркоплазматический ретикулюм
+ выход ионов кальция в протоплазму клетки .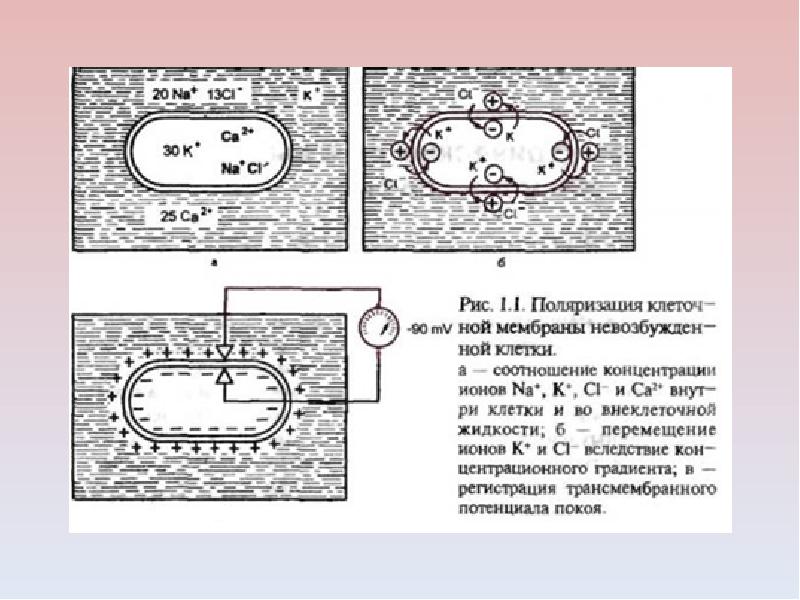
– укорочение миофибрилл
196. Какие события происходят во время периода укорочения (сокращения) скелетной мышцы?
– возникновение распространяющегося возбуждения
– выделение ионов кальция из саркоплазматического ретикулюма
+ взаимодействие ионов кальция с тропонином
+ взаимодействие между актином и миозином
+ расходование энергии АТФ
197. Какие события происходят во время расслабления скелетной мышцы?
+ транспорт ионов кальция в саркоплазматический ретикулюм
– выход ионов кальция из саркоплазматического ретикулюма
– взаимодействие актина и миозина
+ блокада актина тропомиозином
– возникновение потенциала действия
198. Какие белки скелетных мышц принимают участие в реализации сокращения?
+ актин
+ миозин
– тропонон
– тропомиозин
– кальмодулин
199. Какие причины обусловливают тетаническое сокращение скелетных мышц?
– редкая стимуляция
+ частая стимуляция
– длительный период рефрактерности
+ короткий период рефрактерности
– отсутствие ионов кальция
200. Какие ионы обеспечивают электромеханическое сопряжение в скелетных мышцах?
Какие ионы обеспечивают электромеханическое сопряжение в скелетных мышцах?
– ионы натрия ионы калия
+ ионы кальция
– ионы хлора
– ионы магния
201. Каковы особенности функционирования гладкомышечных клеток?
– высокий расход энергии
+ наличие автоматам
+ малая скорость сокращения
+ высокая чувствительность к химическим факторам
– низкая пластичность
202. Каковы особенности электромеханического сопряжения в клетках гладких мышцах?
+ обеспечивается ионами кальция
– обеспечивается ионами калия
– рецепторным белком является тропонин
+ рецепторным белком является кальмодулин
+ сокращение возникает в ответ на потенциал действия
203. Какие белки гладкомышечных клеток участвуют в активации и реализации сокращения?
+ актин
+ миозин
– тропонин
+ тропомиозин
+ кальмодулин
204. Что характерно для гладких мышц, обладающих спонтанной активностью?
Что характерно для гладких мышц, обладающих спонтанной активностью?
– постоянный уровень мембранного потенциала покоя
– высокий расход энергии
+ спонтанные колебания потенциала покоя
+ периодически возникающие потенциалы действия
+ медленные процессы сокращения и расслабления
205. В каких режимах могут сокращаться гладкие мышцы?
+ изометрический
+ изотонический
+ ауксотонический
206. Что характерно для гладких, мышц, которые не обладают спонтанной активностью?
+ возбуждаются только от серии нервных импульсов
+ возбуждение от одной клетки к другой проводится через нексус
+ медленное сокращение
+ медленное расслабление
– высокий расход энергии
207. Какие черты характеризуют функциональные особенности гладкомышечных клеток внутренних органов?
+ сократимость
– высокий расход энергии
+ низкий расход энергии
+ высокая пластичность
+ малые скорости сокращения и расслабления
208. Что характерно для гладкомышечных клеток?
Что характерно для гладкомышечных клеток?
+ сократимость
+ высокая пластичность
+ малый расход энергии
+ медленное сокращение
+ медленное расслабление
209. Каковы особенности электромеханического сопряжения в гладкомышечных клетках?
+ сокращение может возникать в ответ на деполяризацию мембран
+ связующим звеном являются ионы кальция
– обеспечивается ионами калия
+ рецепторным белком является кальмодулин
– возникает при выходе ионов кальция из клетки
210. Какими физическими особенностями отличаются гладкомышечные клетки от поперечнополосатых мышц?
– большая возбудимость
+ меньшая возбудимость
+ высокая чувствительность к химическим факторам
+ наличие автоматам
+ большая пластичность
211. С каким белком взаимодействуют ионы кальция, активируя процесс сокращения в гладкомышечных клетках?
– миоглобин
– тропомиозин
+ кальмодулин
– актин
– трансферрин
212. Что характерно для гладкомышечных клеток стенки тонкого кишечника?
Что характерно для гладкомышечных клеток стенки тонкого кишечника?
– высокий расход энергии
– высокая скорость сокращения
– малая продолжительность сокращения
– быстрое развитие процесса утомления
+ автоматия
213. Что характерно для функционирования гладких мышц?
– высокая скорость укорочения
+ малая скорость сокращения и расслабления
– высокие энергозатраты
+ низкие энергозатраты
+ способны к длительному тоническому сокращению
214. Каковы функциональные особенности гладкомышечных клеток?
+ малая скорость сокращения
– большая скорость сокращения
+ высокая пластичность низкая пластичность
– высокий расход энергии при сокращении
215. Какими свойствами обладают гладкомышечные клетки?
+ возбудимость
+ проводимость
+ сократимость
+ автоматия
+ пластичность
216. Каковы особенности сократительной активности гладкомышечных клеток кровеносных сосудов?
– высокая скорость расслабления
+ низкая скорость расслабления
– большая скорость сокращения
+ малая скорость сокращения
217. Как называется то наименьшее время, в течение которого должен действовать на ткань раздражитель удвоенной реобазы, чтобы вызвать возбуждение?
Как называется то наименьшее время, в течение которого должен действовать на ткань раздражитель удвоенной реобазы, чтобы вызвать возбуждение?
– атаксия
– асфиксия
+ хронаксия
– полезное время
– хроноинотропия
218. Как называется совокупность органов или тканей, связанных
– адаптация
– гомеокинез
– гемостаз
+ система
– гомеостаз
219. Как называется место контакта аксона нервной клетки с любой другой клеткой?
– нексус
– хронаксия
– реобаза
+ синапс
– десмосома
220. Как называется длительное непрерывное сокращение скелетной мышцы, обусловленное действием частых стимулов?
+ тетанус
– реобаза
– хронаксия
– деполяризация
– гииериоляризация
221. Как называется снижение мембранной разности потенциалов «следствие увеличения проницаемости мембраны возбудимой клетки для ионов натрия?
– гиперполяризация
+ деполяризация
– реполяризация
222. Как называется место контакта аксона нервной клетки с мышечной клеткой?
Как называется место контакта аксона нервной клетки с мышечной клеткой?
– нексус
– хронаксия
– реобаза
+ синапс
– десмосома
223. Как называется состояние невозбудимости нервной клетки во время генерации потенциала действия?
– реципрокность
– амфотерность
– реобазность
– возбудимость
+ рефрактерность
224. Какое из указанных образований обладает наименьшей утомляемостью?
– скелетная мышца
+ нервное волокно
– гладкая мышца
– синапс
– сердечная мышца
225. Как называется состояние невозбудимости мышечной ткани во время возникновения распространяющегося возбуждения?
– реципрокность
– амфотерность
– реобазность
+ рефрактерность
– возбудимость
226. Как называется морфо-функциональный элемент нервно- мышечного аппарата?
– синапс
– миофибрилла
– нейрофибрилла
– единица силы
+ нейро-моторная (двигательная) единица
227. Какое из указанных образований обладает наибольшей утомляемостью?
Какое из указанных образований обладает наибольшей утомляемостью?
– скелетная мышца
– гладкая мышца
– рецептор
+ синапс
– нервное волокно
228. Как называется совокупность физиологических механизмов, поддерживающая константы организма на оптимальном уровне?
– гистерезис
– гемостаз
– рефлекс
+ гомеостаз
229. Как называется минимальная сила раздражителя, необходимая для возникновения ответной реакции?
– субнормальная
– неадекватная
– супернормальная
+ пороговая
– полезная
230. Как называется группа мышечных волокон, иннервируемая |ш;шстш1ением аксона мотонейрона?
– синапс
– дивергенция
+ нейро-моторная (двигательная) единица
– силовая единица
– геликотерма
231. Кик называется возникновение разности потенциалов между наружной и внутренней поверхностью мембраны нервной клетки?
– деполяризация
– герполяризация
+ поляризация
– седиментация
– агрегация
232. Как называется свойство возбудимых тканей воспроизводить определенное количество импульсов (ПД) в единицу времени?
Как называется свойство возбудимых тканей воспроизводить определенное количество импульсов (ПД) в единицу времени?
– рефрактерность
– возбудимость
– пергюнтивность
+ лабильность
– реципрокность
233. Как называется сокращение мышцы, при котором ее длина не меняется, а напряжение растет?
+ изометрическое
– изотоническое
– ауксотоническое
– изоволюмическое
– аутоиммунное
234. Как называется уменьшение величины мембранного потенциала нервных клеток?
– поляризация
– гиперполяризация
+ деполяризация
– экзальтация
– миелинизация
235. С помощью какого прибора можно зарегистрировать время ответной реакции мышцы при действии электрического тока в две реобазы?
– кимограф
– миограф
– полярограф
+ хронаксиметр
– рефлексометр
236. С помощью какого прибора можно зарегистрировать время ответной реакции нерва при действии электрического тока в две реобазы?
– кимограф
– миограф
– полярограф
+ хронаксиметр
– рефлексометр.
Торможение нейронов в мозге продлило жизнь червям и мышам
Американские биологи продлили жизнь нематодам и мышам, подавив у них активность нейронов в мозге. Возбуждение нейронов, напротив, приблизило наступление смерти даже у долгоживущих мутантов. У людей, судя по всему, этот механизм тоже работает — по крайней мере, у долгожителей, в отличие от более молодых людей, в нейронах подавлена работа генов, которые связаны с передачей возбуждающего сигнала. За это подавление отвечает белок REST, который теперь называют одной из мишеней для продления жизни. Исследование опубликовано в журнале Nature.
Исследование опубликовано в журнале Nature.
Ограничение калорий — самый достоверный способ продлить жизнь практически любому животному. При этом организм выделяет меньше инсулина или его аналогов, а в клетках прекращает работу главный стимулятор обмена веществ — белок TOR. В результате клетки переключаются на более экономный режим: производят меньше белков, запасают меньше еды впрок и тратят меньше ресурсов «впустую», что суммарно позволяет им медленнее изнашиваться, а организму в целом — дольше жить.
Известно также, что активность нервной системы может быть связана с продолжительностью жизни. Например, лишенные обоняния нематоды живут дольше здоровых особей — вероятно, потому что в отсутствие запаха еды производят меньше инсулина. Нечувствительность к боли тоже продлевает жизнь — возможно, именно этим объясняется феномен долгожительства голого землекопа.
Джозеф Зулло (Joseph Zullo) и Дерек Дрейк (Derek Drake) с коллегами из Гарвардского университета попробовали установить связь между изменением обмена веществ, активностью нервной системы и продолжительностью жизни. Они оттолкнулись от трех баз данных — ROSMAP, CommonMind Consortium (CMC) и Gibbs — которые собрали результаты секвенирования РНК в клетках мозга у людей разного возраста. Сравнив количество разных РНК (то есть фактически активность соответствующих генов) у долгожителей (старше 85 лет) и пожилых людей (до 80 лет), исследователи обнаружили, что у первых подавлена работа генов, связанных с возбуждением нейронов. Гены, которые отвечают за процессы торможения нейронов, работали и у долгожителей, и у пожилых людей примерно одинаково.
Они оттолкнулись от трех баз данных — ROSMAP, CommonMind Consortium (CMC) и Gibbs — которые собрали результаты секвенирования РНК в клетках мозга у людей разного возраста. Сравнив количество разных РНК (то есть фактически активность соответствующих генов) у долгожителей (старше 85 лет) и пожилых людей (до 80 лет), исследователи обнаружили, что у первых подавлена работа генов, связанных с возбуждением нейронов. Гены, которые отвечают за процессы торможения нейронов, работали и у долгожителей, и у пожилых людей примерно одинаково.
Ученые предположили, что приглушенная активность нейронов может быть связана с долголетием, и проверили эту гипотезу на нематодах C. elegans. У червей заблокировали кальциевый канал, чтобы снизить возбудимость клеток, и животные прожили на 25 процентов дольше контрольной группы. Эффект проявился даже тогда, когда блокировать возбудимость начали уже у пожилых животных. Это означает, что эффект не может быть объяснен ограничением калорий — взрослые нематоды и без того едят мало.
Затем исследователи вывели линию трансгенных нематод, нейроны которых несли на себе хлорный канал. Он реагировал на добавление гистамина и подавлял работу нервных клеток, на которых был расположен. Ученые сначала затормозили таким образом работу нервной системы в целом и зафиксировали продление жизни червей. А потом они запустили канал избирательно в глутаминергических и холинергических нейронах, которые отвечают за передачу возбуждения. Эффект оказался таким же — следовательно, именно возбуждающие нейроны сокращают жизнь червей своей излишней активностью.
В предыдущей работе эта исследовательская группа показала, что в стареющем мозге человека растет экспрессия гена REST. Он работает как репрессор, то есть подавляет работу генов. Сейчас же исследователи подтвердили, что в том самом наборе генов, которые чаще подавлены у долгожителей, чем у пожилых людей, часто встречаются последовательности для связывания с REST. Они предположили, что именно он ответственен за подавление возбуждения в мозге долгожителей.
Ученые вывели линию трансгенных мышей, у которых можно было отключать работу гена REST. Они вводили в организм животных флуородезоксиглюкозу, которая светится при расщеплении, и измеряли интенсивность свечения в мозге. Оказалось, что у пожилых мышей с выключенным REST мозг поглощал больше глюкозы, то есть работал активнее.
У нематод тоже есть ортолог REST — ген spr-4. Исследователи усилили его экспрессию искусственно и обнаружили, что при этом возбуждение в нейронах червей снижается, а продолжительность жизни растет. Поскольку работа REST у мышей оказалась связана с поглощением энергии, ученые начали экспериментировать с активностью инсулинового пути. Оказалось, что если активировать инсулиновую сигнализацию у червей с повышенной экспрессией spr-4, то это сводит на нет весь эффект продления жизни. И наоборот: если подавить работу spr-4, то выключение инсулиновой сигнализации не продлевает жизни.
Исследователи заключили, что возбуждение нейронов и обмен веществ неразрывно связаны: интенсивное поглощение глюкозы влечет за собой гиперактивность нервных клеток.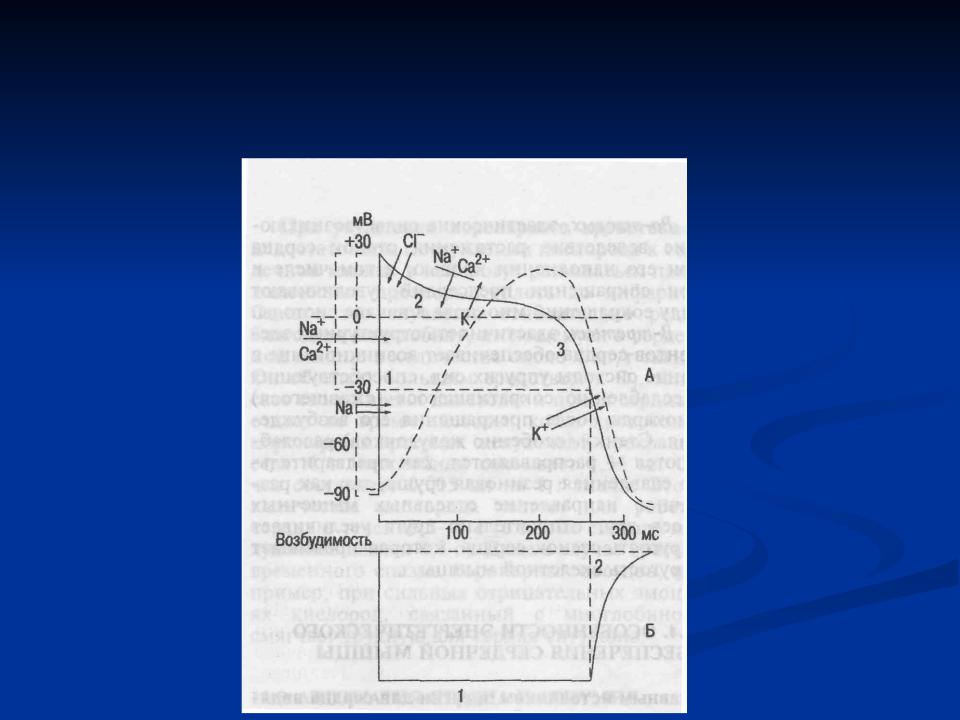 И, судя по всему, этим частично объясняется влияние ограничения калорий на продолжительность жизни.
И, судя по всему, этим частично объясняется влияние ограничения калорий на продолжительность жизни.
Как сообщает STAT, процесс публикации статьи занял у ученых около двух лет — столько времени потребовалось, чтобы предоставить дополнительные данные и убедить рецензентов в том, что эксперименты проведены честно. Сами исследователи и не связанные с этой группой геронтологи называют результаты удивительными и контринтуитивными — ведь у людей именно активность головного мозга считается признаком «здоровой старости» и долголетия. Тем не менее, на клеточном уровне предпосылки к этому открытию были известны уже давно — и то, что экономный обмен веществ способствует долгой жизни, и то, что у долгоживущих мутантов подавлены некоторые типы нервной сигнализации.
Исследователи отмечают, что о конкретных применениях их результатов на людях речи пока не идет. Однако не исключают и того, что белок REST в мозге человека может стать многообещающей мишенью для антиэйджинговой терапии.
Раньше мы уже рассказывали о том, что ограничение калорий может быть не только постоянным, но и временным — и такое интервальное голодание тоже помогает жить дольше, по крайней мере, мышам. А блокаторы белка TOR, который регулирует обмен веществ, давно уже используют у разных животных — например, на его основе создают «коктейли» для борьбы со старостью у мух.
А блокаторы белка TOR, который регулирует обмен веществ, давно уже используют у разных животных — например, на его основе создают «коктейли» для борьбы со старостью у мух.
Полина Лосева
ИЗМЕНЕНИЯ ВОЗБУДИМОСТИ КЛЕТКИ ВО ВРЕМЯ ЕЕ ВОЗБУЖДЕНИЯ. ЛАБИЛЬНОСТЬ — Студопедия
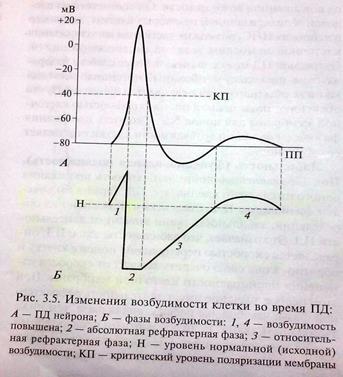
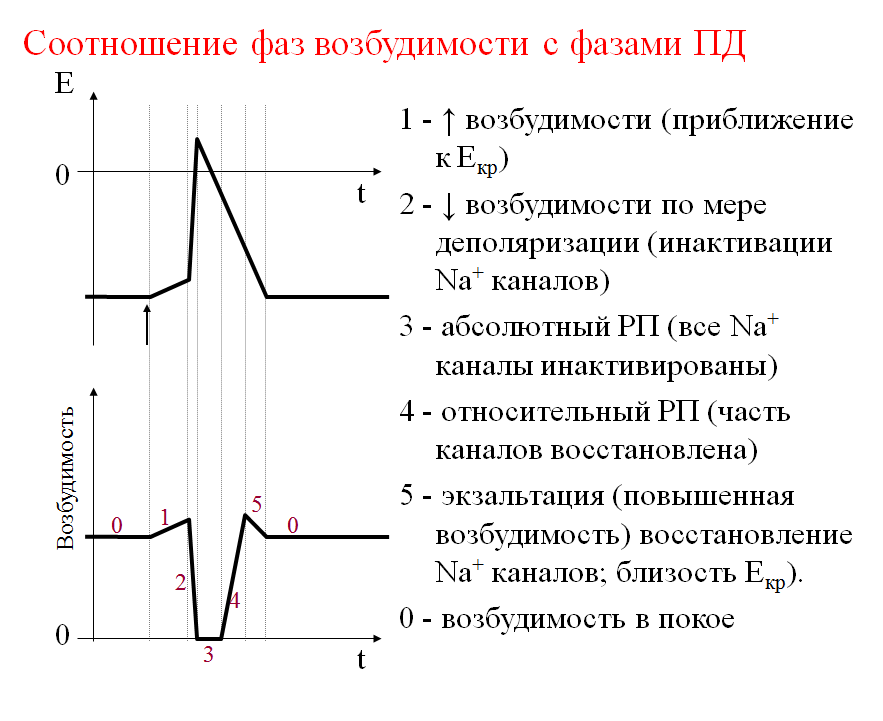
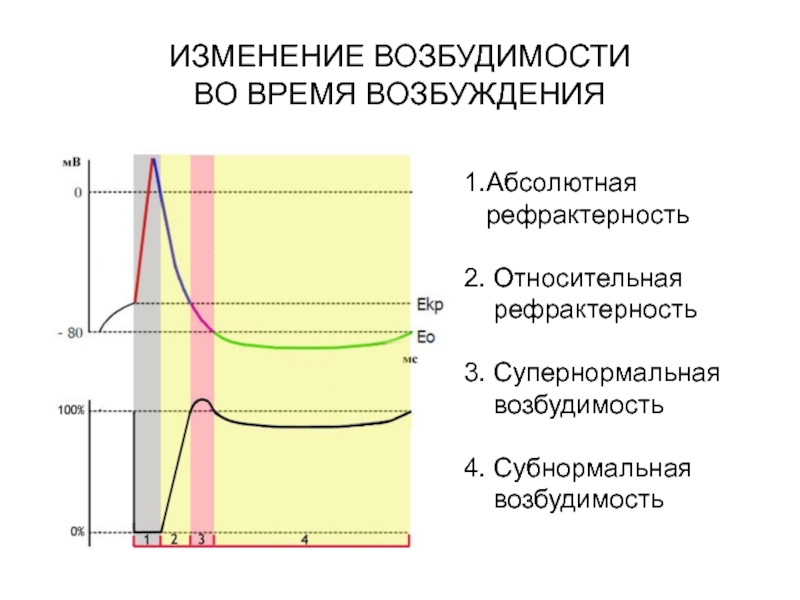
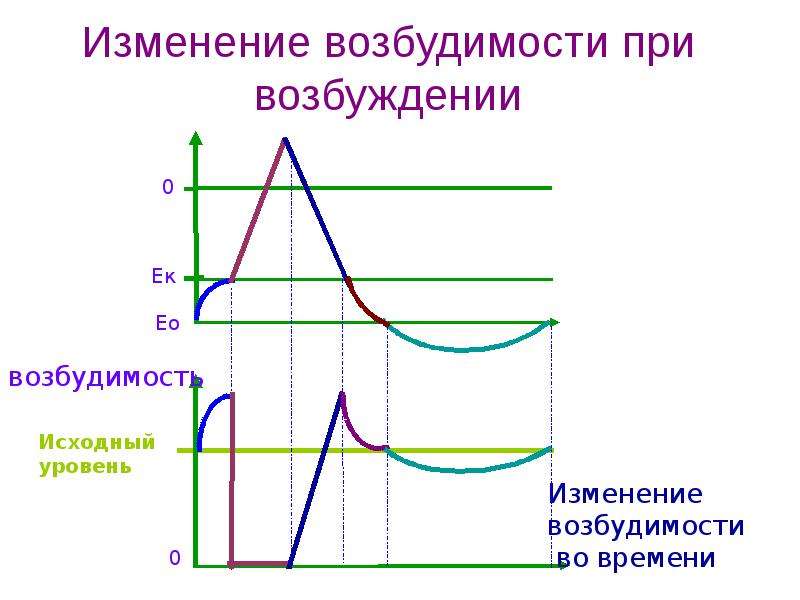
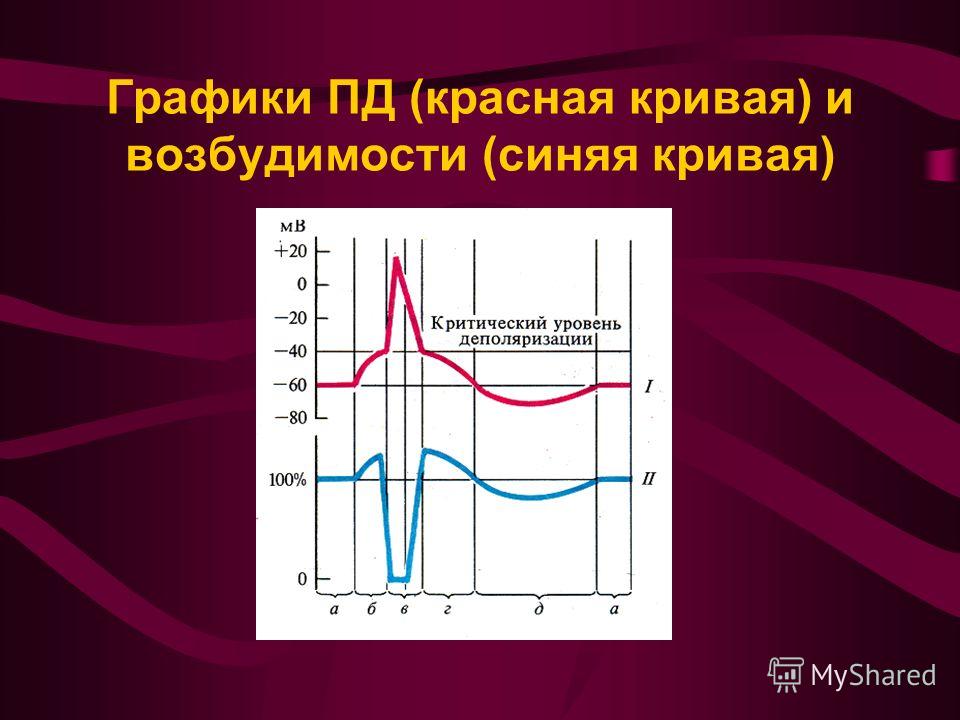
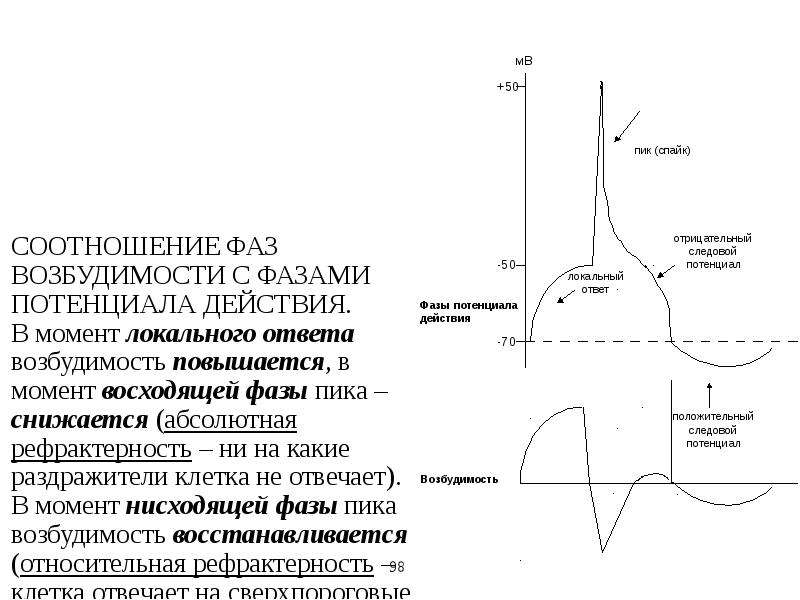
А. Возбудимость клетки во время ее возбуждения быстро и сильно изменяется. Различают несколько фаз изменения возбудимости, каждая из которых строго соответствует определенной фазе ПД и так же, как и фазы ПД, определяется состоянием проницаемости клеточной мембраны для ионов. Схематично эти фазы представлены на рис. 1.4 — Б.
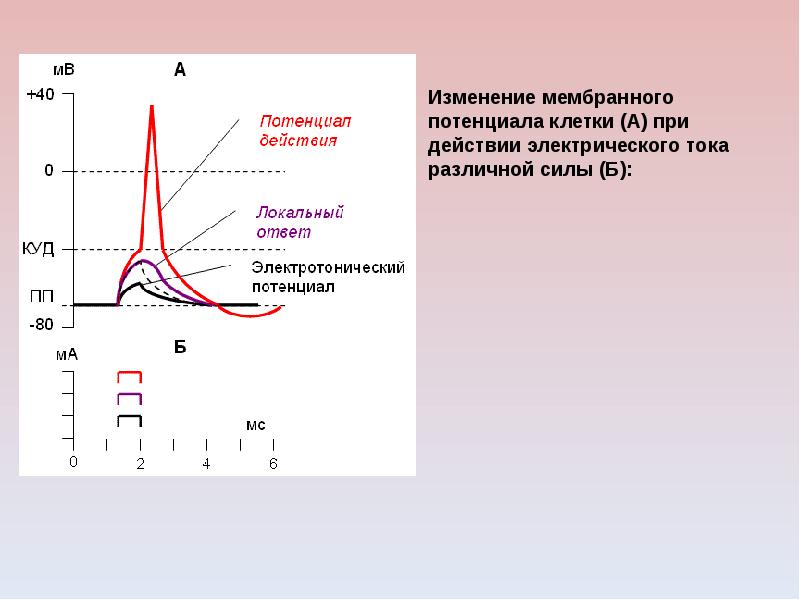
1. Кратковременное повышение возбудимости в начале развития ПД, когда уже возникла некоторая деполяризация клеточной мембраны. Если деполяризация не достигает критической величины, то регистрируется локальный потенциал. льные быстрые №-каналы. При этом достаточно небольшого увеличения силы раздражителя, чтобы деполяризация достигла Е , при которой возникает ПД.
льные быстрые №-каналы. При этом достаточно небольшого увеличения силы раздражителя, чтобы деполяризация достигла Е , при которой возникает ПД.
2. Абсолютная рефрактерная фаза — это полная невозбудимость клетки (возбудимость равна нулю), она соответствует пику ПД и продолжается 1-2 мс; если ПД более продолжителен, то более продолжительна и абсолютная рефрактерная фаза. Клетка в этот период времени на раздражения любой силы не отвечает. Невозбудимость клетки в период восходящей части пика ПД объясняется тем, что потенциалзависимые ворота №- каналов уже открыты и №+ быстро поступает в клетку по всем открытым каналам. Те ворота Ыа-каналов, которые еще не успели открыться, открываются под влиянием деполяризации — уменьшения мембранного потенциала. Поэтому дополнительное раздражение клетки относительно движения Ыа+ в клетку ничего изменить не может. Именно поэтому ПД либо совсем не возникает при раздражении, если оно мало, либо возникает максимально, если действует раздражение достаточной силы (пороговой или сверхпороговой). В период нисходящей части пика ПД клетка невозбудима потому, что закрыты ворота Ыа-каналов, в результате чего клеточная мембрана непроницаема для №+ даже при сильном раздражении. Кроме того, в этот период открыты ворота К-каналов, К+ быстро выходит из клетки, обеспечивая нисходящую часть фазы инверсии и реполяризацию. Абсолютный рефрактерный период ограничивает максимальную частоту генерации ПД. Если абсолютный рефрактерный период завершается через 2 мс после начала ПД, клетка может возбуждаться с частотой максимум 500 имп/с.
В период нисходящей части пика ПД клетка невозбудима потому, что закрыты ворота Ыа-каналов, в результате чего клеточная мембрана непроницаема для №+ даже при сильном раздражении. Кроме того, в этот период открыты ворота К-каналов, К+ быстро выходит из клетки, обеспечивая нисходящую часть фазы инверсии и реполяризацию. Абсолютный рефрактерный период ограничивает максимальную частоту генерации ПД. Если абсолютный рефрактерный период завершается через 2 мс после начала ПД, клетка может возбуждаться с частотой максимум 500 имп/с.
3. Относительная рефрактерная фаза — это период восстановления возбудимости клетки, когда сильное раздражение может вызвать новое возбуждение (рис. 1.4, Б-3). Относительная рефрактерная фаза соответствует конечной части фазы реполя-ризации (начиная примерно от Е ± ЮмВ) и следовой гиперполяризации клеточной мембраны, если она имеется. Пониженная возбудимость является следствием все еще повышенной проницаемости для К+ и избыточным выходом К+ из клетки. Поэтому,
Поэтому,
чтобы вызвать возбуждение в этот период, необходимо приложить более сильное раздражение, так как выход К+ из клетки препятствует ее деполяризации. Кроме того, в период следовой гиперполяризации мембранный потенциал больше и, естественно, дальше отстоит от критического уровня деполяризации. Если реполяризация в конце пика ПД замедляется, то относительная рефрактерная фаза включает и период замедления реполяризации, и период гиперполяризации, т. е. продолжается до возвращения мембранного потенциала к исходному уровню после гиперполяризации. Продолжительность относительной рефрактерной фазы вариабельна, у нервных волокон она невелика и составляет несколько мс.
4. Фаза экзальтации — это период повышенной возбудимости. Он соответствует следовой деполяризации. В некоторых клетках, например в нейронах ЦНС, возможна частичная деполяризация клеточной мембраны вслед за гиперполяризацией. Очередной ПД можно вызывать более слабым раздражением, поскольку мембранный потенциал несколько ниже обычного и он оказывается ближе к критическому уровню деполяризации, что объясняют повышенной проницаемостью клеточной мембраны для ионов Ыа+.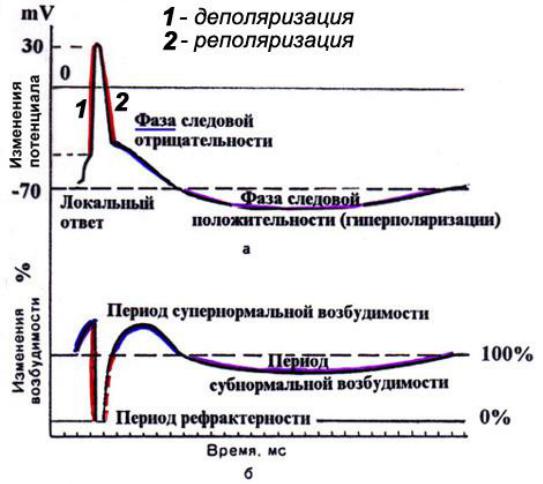 Скорость протекания фазовых изменений возбудимости клетки определяет ее лабильность.
Скорость протекания фазовых изменений возбудимости клетки определяет ее лабильность.
Б. Лабильность, или функциональная подвижность (Н.Е. Введенский), — это скорость протекания одного цикла возбуждения, то есть ПД. Как видно из определения, лабильность ткани зависит от длительности ПД. Это означает, что лабильность, как и ПД, определяется скоростью перемещения ионов в клетку и из клетки, которая в свою очередь зависит от скорости изменения проницаемости клеточной мембраны. При этом особое значение имеет длительность рефрактерной фазы — чем больше рефрактерная фаза, тем ниже лабильность ткани.
Мерой лабильности является максимальное число ПД, которое ткань может воспроизвести в 1 с. В эксперименте лабильность исследуют в процессе регистрации максимального числа ПД, которое может воспроизвести клетка при увеличении частоты ритмического раздражения. Лабильность различных тканей существенно различается. Так, лабильность нерва равна 500-1000, мышцы -около 200, нервно-мышечного синапса — порядка 100 импульсов в секунду. Лабильность ткани понижается при длительном бездействии органа и при утомлении, что необходимо учитывать в процессе тренировки спортсменов.
Лабильность ткани понижается при длительном бездействии органа и при утомлении, что необходимо учитывать в процессе тренировки спортсменов.
Следует отметить, что при постепенном увеличении частоты ритмического раздражения лабильность ткани повышается, т. е.
ткань отвечает более высокой частотой возбуждения по сравнению с исходной частотой. Это явление открыто А. А. Ухтомским и называется усвоением ритма раздражения.
БИОПОТЕНЦИАЛЫ • Большая российская энциклопедия
В книжной версии
Том 3. Москва, 2005, стр. 522-523
Скопировать библиографическую ссылку:
Авторы: Л. Г. Магазаник
Г. Магазаник
БИОПОТЕНЦИА́ЛЫ (биологические потенциалы), электрич. потенциалы, существующие во всех живых клетках. Образуются в результате разделения электрич. зарядов на клеточной мембране, т. к. основу мембраны составляют фосфолипиды, препятствующие свободной диффузии ионов. Концентрация ионов калия внутри нервной или мышечной клетки примерно в 50 раз выше, чем снаружи. Напротив, внеклеточная жидкость содержит намного больше ионов натрия, кальция и хлора. Ионная асимметрия поддерживается благодаря наличию в мембране двух типов белковых включений: каналов, через которые определённые типы ионов могут перемещаться путём диффузии в соответствии с концентрационным градиентом, и ионных насосов, которые при определённых энергетич. затратах переносят ионы против концентрационного градиента. Т. о. создаётся и поддерживается разность потенциалов между внутренней (заряжена отрицательно) и наружной (заряжена положительно) поверхностями мембраны клетки, т. е. мембранный потенциал, амплитуда которого обычно составляет от –50 до –90 мВ. Такое равновесное состояние называют также потенциалом покоя, в отличие от относительно кратковрем. колебаний уровня потенциала, возникающих вследствие изменения проницаемости ионных каналов, что влечёт за собой увеличение (или уменьшение) потока определённых ионов через мембрану.
Переход ионных каналов из закрытого в открытое состояние управляется изменениями мембранного потенциала или химич. веществами, в т. ч. медиаторами. Так, ацетилхолин открывает для катионов специфич. ионные каналы в мембране мышечной клетки – холинорецепторы, вследствие чего уменьшается разность потенциалов (деполяризация мембраны). Быстрое колебание мембранного потенциала называют возбуждающим потенциалом. Если эта деполяризация достигает определённого порога, то потенциалзависимые натриевые каналы на короткое время переходят в открытое состояние, порождая потенциал действия, достигающий значений от –90 до –120 мВ. Продолжительность его действия мала (ок. 1,5 мс), т. к. вместе с натриевыми открываются потенциалзависимые калиевые каналы, что ведёт к восстановлению исходного уровня мембранного потенциала (реполяризации), и клетка вновь становится способной генерировать потенциал действия в ответ на деполяризующий сигнал. Т. о., потенциал действия способен быстро и без потери амплитуды распространяться вдоль мышечных волокон или аксонов нервных клеток, тем самым запуская мышечное сокращение или осуществляя передачу сигналов по нерву. В волокнах сердечной мышцы длительность потенциала действия достигает 90–600 мс, в его генерации принимают участие также потенциалзависимые кальциевые каналы. Это является непременным условием синхронной и ритмичной сократительной деятельности клеток миокарда, обеспечивающей насосную функцию сердца. Если медиатор управляет открытием калиевых или хлорных каналов для ионов K+ и Cl–, то происходит гиперполяризация клетки. Амплитуда мембранного потенциала кратковременно увеличивается, т. е. появляются тормозные сигналы, приводящие к снижению возбудимости клетки. Изменения мембранного потенциала могут вызываться также путём активации каналов механич. воздействиями, фотонами света, изменениями температуры, сдвигами рН внеклеточной жидкости. В клетках, мембрана которых снабжена чувствительными к подобным воздействиям каналами, возникают потенциалы, дающие начало специфич. ощущениям (слух, вкус, зрение, осязание, боль, определение положения тела и его частей в пространстве, восприятие тепла и холода). Неравномерное распределение ионов по обе стороны клеточной мембраны определяет природу Б. и в растит. клетках. Возникновение медленно изменяющихся Б. в клетках растений в большей мере определяется ионами кальция или хлора.
Б. могут быть измерены в эксперименте внутриклеточными микроэлектродами. Результаты таких измерений используются при исследовании разнообразных физиологич. функций. С помощью поверхностных электродов вне клетки могут регистрироваться суммарные изменения Б. большого числа активных в данный момент клеток (целых нервов, мышц, мозга и т. п.). Измерения Б. имеют важное диагностич. значение. Так, электромиограмма представляет собой результат сложения потенциалов действия множества скелетных мышечных волокон; электрокардиограмма – суммирует колебания Б. мышечных клеток сердца; электроэнцефалограмма – Б. структур мозга; электроретинограмма даёт представление о работе сетчатки глаза. См. также Биологические мембраны, Ионные каналы, Ионные насосы.
Гиперактивность нейронов сокращает жизнь
Исследователи впервые получили доказательство того, что деятельность нервной системы влияет на продолжительность жизни.
Несколько лет назад специалисты из Гарвардской медицинской школы начали изучать экспрессию генов в тканях головного мозга пожилых людей. В распоряжении учёных были сотни образцов, полученных от когнитивно здоровых людей, умерших в возрасте от 60 до 100 лет.
Команда заметила любопытную корреляцию. Чем больше прожил человек, тем менее активны были его гены, связанные с нервным возбуждением (разница была хорошо заметна в тканях людей, проживших менее 80 и более 85 лет).
Но существует ли причинно-следственная связь? Могут ли уровни возбуждения клеток мозга непосредственно влиять на продолжительность жизни? Если да, то как?
Чтобы найти ответы, учёные провели множество экспериментов, включая генетические, клеточные и молекулярные тесты с модельными круглыми червями Caenorhabditis elegans, анализы генетически модифицированных мышей и дополнительный анализ тканей мозга людей, которые прожили более века.
Эксперименты показали, что уровень нейронной активности действительно влияет на продолжительность жизни. А ключевая роль отведена белку под названием REST (эту аббревиатуру можно перевести как «отдых»).
Блокировка этого белка у животных (при помощи препаратов либо генетических модификаций) приводила к повышению нейронной активности и сокращению продолжительности жизни. А повышение выработки этого белка, напротив, подавляло возбудимость клеток мозга и увеличивало продолжительность жизни (показатель червей, к примеру, составил целых 30%).
Мыши, у которых отсутствовал белок REST (снимки нижнего ряда), демонстрировали гораздо более высокую нейронную активность, чем обычные мыши (снимки верхнего ряда).
При этом отмечается, что снижение нейронной активности, вызванное усилением экспрессии REST, не приводило к каким-либо дисфункциональным изменениям.
«Животные могли функционировать, их мозг не «впадал в спячку». Однако, подавив нейронную активность, можно повлиять на процесс старения», – поясняет старший автор нового исследования профессор Брюс Янкнер (Bruce Yankner).
Между тем у людей-долгожителей было обнаружено значительно больше белка REST в ядрах их клеток мозга, чем у людей, скончавшихся в 70 или 80 лет.
«Когда в жизни человека клетки мозга наиболее уязвимы? Первый раз – во время развития плода, когда потеря молодых нейронов приведёт к весьма печальным последствиям. Второй – во время старения, когда на вас воздействуют окислительный стресс и неправильно свёрнутые или агрегированные белки, такие как бета-амилоид и тау-белок. Логично, что в эти два периода должна включаться система защиты нейронов, которые по большей части не восстанавливаются», – рассуждает Янкнер.
Команда также полагает, что REST, влияя на нейронную активность в стареющем мозге, может либо увеличивать вероятность нейродегенерации, либо, напротив, уменьшать её. Иными словами, изменение содержания этого белка в пожилом возрасте может играть роль в возникновении старческого слабоумия (деменции) и болезни Альцгеймера.
На первый взгляд выводы исследования могут показаться несколько нелогичными (оно даже рецензирование проходило целых два года).
Так, согласно общепринятому мнению, пожилым людям следует тренировать мозг, поскольку с годами эффективность мыслительных процессов снижается. Однако Янкнер поясняет, что вид чрезмерной нейронной активности, упомянутый в его исследовании, это не то же самое, что активность, которая имеет место при выполнении упражнений для тренировки мозга. В данном случае речь идёт о гипервозбудимости, которая связана со структурной дегенерацией, наблюдаемой, к примеру, при болезни Альцгеймера.
Авторы исследования надеются, что полученные данные откроют новые пути к разработке лекарств против старения и нейродегенеративных расстройств.
Однако потребуется больше исследований, чтобы поверить, смогут ли препараты, нацеленные на белок REST, а также другие способы изменения нейронной активности (например, медитация) увеличить продолжительность жизни людей и спасти их мозг от возрастных заболеваний.
Подробнее о проделанной работе рассказывается в статье, опубликованной в журнале Nature.
Кстати, ранее «Вести.Наука» (nauka.vesti.ru) рассказывали о нейронной активности интеллектуалов и о том, какое нарушение в работе мозга пожилых людей отвечает за потерю памяти.
Возбудимость
Некоторые клетки и ткани (нервная, мышечная и железистая) специально приспособлены к осуществлению быстрых реакций на раздражение. Такие клетки и ткани называют возбудимыми, а их способность отвечать на раздражение возбуждением называют возбудимостью.
Мерой возбудимости служит та минимальная сила раздражителя, которая вызывает возбуждение. Эта минимальная сила раздражения носит название порога раздражения. Чем больше минимальная сила раздражения, требуемая для вызова реакций, чем выше порог раздражения, тем ниже возбудимость, и, наоборот, чем ниже порог раздражения, тем выше возбудимость. По отношению к разным раздражителям порог раздражения может быть различен. Особенно высока возбудимость рецепторов по отношению к адекватным раздражителям, например, для раздражения обонятельной клетки достаточно, чтобы на нее подействовало всего несколько молекул пахучего вещества.
Возбуждение
Для возбудимых клеток характерна специфическая форма реагирования на действие раздражителей: в них возникает волнообразный физиологический процесс — возбуждение представляет собой сложную биологическую реакцию, проявляющуюся в совокупности физических, физико-химических, химических процессов и функциональных изменений. Обязательным признаком возбуждения является изменение электрического состояния поверхностной клеточной мембраны. Клетки при возбуждении переходят от состояния физиологического покоя к состоянию свойственной данной клетке физиологической деятельности: мышечное волокно сокращается, железистая клетка выделяет секрет.
В возбудимой клетке постоянно имеется разность электрических потенциалов между ее цитоплазмой и внешней средой, т. е. по обе стороны поверхностной клеточной мембраны. Последняя является, таким образом, поляризованной — ее внутренняя поверхность заряжена отрицательно по отношению к наружной. Эту разность потенциалов называют мембранным потенциалом. Причиной такой разности потенциалов является неравенство концентрации ионов внутри клетки — в ее цитоплазме и снаружи клетки — в окружающей тканевой жидкости: в цитоплазме содержится больше ионов калия и меньше ионов натрия по сравнению с тканевой жидкостью. В состоянии покоя мембрана клетки мало проницаема для ионов Na°. При возбуждении проницаемость мембраны увеличивается, и она пропускает положительно заряженные ионы натрия внутрь клетки, что приводит к понижению мембранной разности потенциалов (деполяризации мембраны) и даже к появлению разности потенциалов противоположного знака.
Изменение электрической разности потенциалов при возбуждении получило название потенциала действия. Электрический же ток, возникающий при соединении возбужденного участка ткани с невозбужденным, называют током действия.
Возбуждение представляет собой как бы взрывной процесс, возникающий в результате изменения проницаемости мембраны под влиянием раздражителя. Это изменение вначале относительно невелико и сопровождается лишь небольшой деполяризацией, небольшим уменьшением мембранного потенциала в том месте, где было приложено раздражение, и не распространяется вдоль возбудимой ткани (это так называемое местное возбуждение). Достигнув критического – порогового — уровня, изменение разности потенциалов лавинообразно нарастает и быстро — в нерве за несколько десятитысячных долей секунды — достигает своего максимума.
Восстановление исходной разности потенциалов – реполяризация мембраны — происходит вначале за счет выхода ионов калия из клетки. Затем благодаря особому физиологическому механизму, так называемому натрий-калиевому насосу, восстанавливается неравенство ионных концентраций между цитоплазмой и окружающей клетку средой (ионы калия обратно входят в клетку, а ионы натрия выходят из нее). Этот восстановительный процесс требует некоторой затраты энергии, поставщиком которой являются процессы обмена веществ.
Характерной особенностью клетки в момент ее возбуждения — в период максимальной деполяризации мембраны — является ее неспособность отвечать на новое раздражение. Состояние невозбудимости клетки во время ее возбуждения носит название рефрактерности.
Возбуждение — волнообразно распространяющийся процесс. Возникнув в одной клетке или в одном ее участке, например в одном участке нервного волокна, возбуждение распространяется, переходит на другие клетки или на другие участки той же клетки. Проведение возбуждения обусловлено тем, что потенциал действия, возникший в одной клетке или в одном ее участке, становится раздражителем, вызывающим возбуждение нужных участков.
Возбуждение от одной нервной клетки к другой или от нервного волокна к мышечной или железистой клетке передается химическим путем. В нервном окончании образуются химические соединения — передатчики нервного импульса (ацетилхолин, норадреналин и др.), вызывающие возбуждение в той возбудимой клетке, на которой расположено нервное окончание. Химические передатчики нервного импульса называются медиаторами.
3_1 Работа нервных клеток | Кинезиолог
Введение
В любом учебнике, где есть раздел о нервной системе, можно посмотреть, как устроена нервная система, из каких отделов она состоит. Это объясняют и в учебниках по анатомии, и в учебниках по физиологии… Да и на этом сайте есть подобные материалы: смотри, например, раздел .
Но вот как всё это работает?
Вот в чём главный вопрос!
Видеофильм о работе нейрона демонстрирует внешние события, отражающие работу нейрона.
Хорошо известно, что для своей работы нервные клетки пользуются электричеством и обмениваются именно электрическими сигналами в виде нервных импульсов. И для начала неплохо было бы узнать, откуда нервные нервные клетки берут для этого электричество!
На этот вопрос — о возникновении электрических зарядов в нервных клетках — даётся ответ в разделе:
После того, как мы поняли, откуда на мембране берутся электрические потенциалы, можно попытаться понять, в чём же заключается работа нервных клеток. Как они пользуются этими электрическими потенциалами и электрически заряженными частицами — ионами?
Нервная система очень сложна. И нервные клетки, из которых она состоит, — это тоже непростые образования!
И всё же можно выделить самое главное в их работе. Мы попробуем разобраться, чем же они занимаются и что они делают главным образом.
Что умеют делать нервные клетки?
Говоря «нервные клетки», обычно имеют в виду нейроны. И это несмотря на то, что к нервным клеткам относятся ещё и глиальные клетки, или глия (смотри: Нейроны и глия в гиппокампе), и клеточные сенсорные рецепторы. Но их всё же следует рассматривать отдельно. Так что мы тоже вслед за остальными будем называть именно нейроны «нервными клетками», используя эти термины как синонимы.
Определение понятия «нейрон»
Нейрон с функциональной точки зрения — это электрохимический динамический преобразователь напряжения с пороговым принципом срабатывания, имеющий гетерохронные электрохимические входы и синхронные химические выходы, обладающие индивидуальной пластичностью. © 2016 Сазонов В.Ф. © 2016 kineziolog.su.
Основные задачи нейрона
Если сформулировать задачи нейрона кратко и образно, то получится всего 3 главные задачи.
1. Восприятие возбуждения.
Происходит восприятие воздействия со стороны других нейронов или сенсорных рецепторов. Воздействие — это химический выброс медиаторов и их связывание с мембранными рецепторами нейрона. Нейрон должен воспринять подходящие (т.е. адекватные) для него химические сигналы (медиаторы) своими воспринимающими молекулярными мембранными рецепторами. Как правило, эти рецепторы сосредоточены в воспринимающих отделах его синапсов — на постсинаптических (иногда их называют также субсинаптическими) участках мембраны. Воспринимающий отдел нейрона — дендриты с синапсами, а точнее — с постсинаптическими мембранами. Результат восприятия возбуждения — возникновение на мембране воспринимающего нейрона локального электрического потенциала.
2. Проведение возбуждения.
Проведение возбуждения — это движение возбуждения от места его возникновения до места передачи, т.е. от пресинаптического окончания дендрита до постсинаптического окончания аксона. Для этого требуется рождение нервного импульса на основе локального возбуждающего потенциала и движение этого нервного импульса по мембране нейрона до постсинаптического окончания аксона, где будет происходить химический выброс медиатора. Таким образом, воздействие на нейрон происходит на одном его участке (обычно на пресинаптическом окончании дендрита), но за счёт проведения это возбуждение оказывается на другом конце нейрона — на окончаниях аксона.
3. Передача возбуждения.
Передача возбуждения — это химический выброс медиатора из окончаний аксона. За счёт выброса медиатора осуществляется воздействие со стороны одного нейрона на другой нейрон (или иные клетки). Нейрон должен оказать химическое воздействие на свои мишени: это другие нейроны, мышечные клетки или железистые клетки. Для этого он выделяет химические управляющие вещества (медиаторы или модуляторы) из окончаний своего передающего отростка — аксона. Передающие окончания заканчиваются пресинаптическими мембранами, через которые нейрон и выделяет свои управляющие вещества.
Итак, нейрон должен воспринимать химические воздействия на своей воспринимающей части, проводить возбуждение в виде нервного импульса и оказывать химическое воздействие своими управляющими веществами на свои мишени с помощью своей передающей части. Для связи между собой разных частей нейрона служат нервные импульсы, пробегающие от воспринимающей части нейрона (дендритных окончаний) к его передающей части (аксонным окончаниям).
Таким образом, нейрон должен выделять свои управляющие вещества в нужное время, в нужном месте, в нужном количестве и нужном качестве. И сам нейрон, в свою очередь, должен воспринимать управляющие воздействия, направленные на него. Если что-то из перечисленного не получится, то нужного воздействия от такого нейрона или вообще не будет, или оно будет не эффективным.
Нервные клетки имеют определённый набор ключевых реакций:
1. Формирование и поддержание мембранного потенциала покоя. Этим обеспечивается возбудимость нейронов.
2. Формирование локальных потенциалов. Этим обеспечивается подпороговое возбуждение нейронов.
3. Генерация потенциала действия и нервного импульса. Этим обеспечивается переход от аналогового к цифровому кодированию информации нейронами.
4. Секреция нейротрансмиттеров (медиаторой и модуляторов). Этим обеспечивается передача возбуждения на другие клетки.
5. Изменение своего внутриклеточного обмена и биосинтеза. Этим обеспечивается пластичность и адаптация нейронов.
6. Изменение своих клеточных структур и свойств. Этим обеспечивается пластичность нейронов.
7 Формирование новых структур, например, новых синапсов. Этим обеспечивается пластичность нервных связей.
8. Движение нервного импульса по мембране нейрона. Этим обеспечивается проведение возбуждения нейронами.
Мембранный потенциал покоя, т.е. разность электрических потенциалов между внутренней и наружной сторонами мембраны, нейроны поддерживают на уровне в среднем -70 мВ и тратят на это до 75% всей своей энергии, полученной за счёт питания.
Подпороговое изменение электрического состояния своей мембраны (). Это проявляется в увеличении возбудимости или, наоборот, в уменьшении возбудимости (торможении).
Порождение нервного импульса (потенциала действия). Смотри:
Выброс специального химического вещества, влияющего на состояние других нервных клеток. Эти вещества называются нейротрансмиттерами (нейромедиаторами и нейромодуляторами). Смотри: . Пожалуй, это и есть главная функция нейрона — выбрасывать управляющие вещества для воздействия на свои мишени.
Изменение обмена веществ в данной клетке в ответ на полученный химический сигнал.
Длительное изменение свойств этой клетки или её отдельных структур. Это очень важная способность живых структур, отличающая их от технических устройств! Нейроны могут видоизменять молекулы своих рабочих белков с помощью их фосфорилирования, т.е. присоединения к ним фосфорных остатков. А также могут синтезировать новые молекулярные рецепторы и встраивать их в свою мембрану.
Это явление называется «пластическими перестройками», а сама способность к таким перестройкам — «пластичность». Именно пластичность нейронов и, в частности, пластичность синапсов, обеспечивает нервной системе такие важнейшие свойства, как память, научение, образование условных рефлексов.
- Важным свойством нейрона является его способность к формированию новых крупных структур в процессе жизнедеятельности. В отличие от механических устройств, нейроны выращивают себе новые отростки, образуют и удаляют шипики, формируют новые синаптические контакты. Эти способности нейронов также относятся к их свойству пластичности.
- Проведение возбуждения — это приём возбуждения на одном своём конце и передача его на другом. Именно это обычно считается наиболее важной функцией нейрона. Но, как мы с вами поняли, это было бы слишком просто!
Деполяризация — это уменьшение электроотрицательности нервной клетки.
Можно сказать, что электрический потенциал мембраны при этом «ползёт вверх», в сторону нуля.
Деполяризация означает возбуждение клетки, деполяризованная клетка — более возбудима, т.е. чувствительна к возбуждению.
Как правило, деполяризацию и улучшение возбудимости нервной клетки производит входящий в неё натрий (положительно заряженные ионы натрия). Хочешь вызвать деполяризацию — впусти в клетку натрий!
Важно отметить, что термин «деполяризация» означает именно утрату поляризации. При этом электрический заряд мембраны уменьшается и стремится к нулю. Клетка с «нулевым» зарядом не поляризована. Если же заряд становится вместо отрицательного положительным, то это тоже означает поляризацию клетки. Только уже положительную. К сожалению, частенько из учебников можно ошибочно сделать вывод, что деполяризация продолжается даже выше нуля, приобретая положительное значение. Это неверно!
Гиперполяризация — это увеличение электроотрицательности нервной клетки.
Термин «гиперполяризация» означает «сверхполяризацию». При этом электрический заряд мембраны «ползёт вниз», т.е. удаляется от нуля.
Гиперполяризация означает торможение клетки, она становится менее возбудимой, т.е. слабо чувствительной к возбуждению.
Как правило, гиперполяризацию можно вызвать двумя способами:
1) запустить в нервную клетку отрицательно заряженные ионы хлора,
2) выпустить из нервной клетки дополнительное количество положительно заряженных ионов калия.
Хочешь вызвать гиперполяризацию и ухудшить возбудимость нервной клетки — запусти в неё хлор или выпусти из неё калий!
Когда деполяризация мембраны достигает определённого критического уровня, то происходит резкий скачок электрического напряжения от отрицательного к положительному и обратно к отрицательному. В этом процессе участвуют ионные каналы мембраны и перемещение ионов натрия и калия.
Важно отметить, что после того как этот процесс начался в одном месте, он, как пожар, охватит всю мембрану нейрона и пробежит по всем его отросткам. Это и есть нервный импульс — распространяющееся возбуждение. Часто в качестве синонима для нервного импульса используют термин «потенциал действия». Однако следует помнить, что понятие «потенциал действия» относится только к электрическому процессу, т.е. отражает лишь часть более общего понятия, такого как «нервный импульс».
Нервный импульс — это волна взаимосвязанных структурных, химических и электрических процессов, пробегающая по мембране нейрона.
Потенциал действия — это резкое скачкообразное изменение электрического заряда мембраны с отрицательного на положительный и обратно на отрицательный.
Проживая свою клеточную жизнь, нейроны постоянно поддерживают себя в электрически заряженном состоянии. Как они это делают, рассматривается нами в разделе: . И при этом время от времени они изменяют свои заряды, а также время от времени делают выбросы биологически активных веществ — трансмиттеров (медиаторов и модуляторов).
Финал
Источник изображения: https://vk.com/doc183608877_438205454?hash=7699673c7e6de140a8&dl=511f143…
Итак, на фоне поддержания своего постоянного электрического заряда (потенциала покоя) нейроны претерпевают деполяризацию и гиперполяризацию, порождают нервные импульсы (потенциалы действия), выделяют нейротрансмиттеры (медиаторы и модуляторы), изменяют свой обмен веществ (метаболизм), или же на долгий срок изменяют свои свойства, используя свою способность к пластичности.
В этом и заключается их клеточная работа на благо всего организма.
А теперь я раскрою вам самую главную тайну о работе нейронов…
Если раньше считалось, что главная работа нейронов — это производство нервных импульсов, то теперь акценты сместились.
Главная работа нейронов — это производство и выделение химических управляющих веществ — нейротрансмиттеров (медиаторов и модуляторов). Именно с помощью своих нейротрансмиттеров нейроны управляют друг другом и всем организмом!
А электрохимические нервные импульсы лишь согласуют эту химическую активность нейронов во времени.
Вот какую великую тайну работы нервных клеток вы постигли вместе со мной.
Возбудимость — обзор | Темы ScienceDirect
Пониженная возбудимость мембраны
Возбудимость сердечной клетки описывает легкость, с которой клетка реагирует на стимул с потенциалом регенеративного действия, и это зависит от пассивных и активных свойств клеточной мембраны. К пассивным свойствам относятся сопротивление и емкость мембраны, а также межклеточное сопротивление. Наиболее важным фактором снижения возбудимости является снижение доступности каналов Na + .Чем отрицательнее мембранный потенциал, тем больше каналов Na + доступно для активации, тем больше приток Na + в клетку во время фазы 0 и тем больше скорость проводимости. Напротив, деполяризация мембраны до уровней от -60 до -70 мВ может инактивировать половину каналов Na + , а деполяризация до -50 мВ или менее может инактивировать все каналы Na + .
Пониженная возбудимость мембран возникает при многих физиологических и патофизиологических состояниях.Когда стимуляция происходит во время фазы 3 (например, преждевременная стимуляция в течение периода относительной рефрактерности), до полного восстановления и при менее отрицательных потенциалах клеточной мембраны, часть каналов Na + все еще будет рефрактерной и недоступной для активации (из-за длительное восстановление каналов Na + от инактивации). В результате I Na и фаза 0 следующего потенциала действия снижаются, а проведение преждевременного стимула замедляется, облегчая повторный вход.Пониженная возбудимость мембран также присутствует в сердечных клетках с постоянно низкими уровнями потенциала покоя, вызванными заболеванием (например, острой ишемией, некоторыми процессами электрического ремоделирования), генетическими мутациями, которые приводят к потере функции канала Na + (например, синдром Бругада) , тахикардия и лечение антиаритмическими средствами I класса. 19
Потенциалы действия с уменьшенной скоростью восходящего хода в результате частичной инактивации каналов Na + называются «подавленными быстрыми откликами».Эти изменения потенциала действия, вероятно, будут неоднородными, с неодинаковыми степенями инактивации Na + , которые создают области с минимально сниженной скоростью, более сильно пониженные зоны и области полного блока. Кроме того, рефрактерность клеток с пониженными мембранными потенциалами может длиться дольше восстановления потенциала действия; то есть, клетка все еще может быть огнеупор или частично огнеупорными после Й м возвращается в своем самом отрицательное значение. При прогрессивном снижении возбудимости генерируется меньше тока источника Na + , а скорость проводимости и коэффициент безопасности монотонно уменьшаются.Когда коэффициент безопасности падает до менее 1, проводимость больше не может поддерживаться, и происходит отказ (блокировка проводимости).
Таким образом, в пораженной области с частично деполяризованными волокнами могут быть некоторые области с медленной проводимостью и некоторые области с блокировкой проводимости, в зависимости от уровня потенциала покоя и количества инактивированных каналов Na + . Эта комбинация может создать основу для повторного входа. Вероятность повторного входа в такие волокна еще выше во время преждевременной активации или во время ритмов с высокой скоростью, потому что медленная проводимость или возможность блокировки еще больше увеличиваются.
Примечательно, что пониженная возбудимость мембраны не поддерживает очень медленную проводимость; скорее, это приводит к переходу к резкому нарушению проводимости при относительно высоких скоростях проводимости (рис. 3.16). Коэффициент безопасности снижается очень медленно и относительно нечувствителен к умеренным изменениям возбудимости мембран. Только когда наблюдается крайнее (90%) снижение доступности канала Na + , генерируемого деполяризующего заряда недостаточно для деполяризации мембраны до порога возбуждения, и коэффициент безопасности резко падает до 1 (в нелинейной системе «все или -» нет »поведения клеточной мембраны и порогового явления, характеризующего процесс возбуждения).
Клеточная возбудимость и регуляция функциональной нейрональной идентичности: от экспрессии генов к нейромодуляции
Внутренние свойства нейрона определяют трансляцию синаптического входа в аксональный выход. Именно эта взаимосвязь между входами и выходами лежит в основе всей деятельности нервной системы. Таким образом, общая регуляция внутренней возбудимости нейрона напрямую определяет выход этого нейрона в данный момент времени, придавая клетке уникальную «функциональную идентичность».«Чтобы поддерживать этот отчетливый функциональный результат, нейроны должны адаптироваться к изменяющимся паттернам синаптического возбуждения. Эти адаптации необходимы для предотвращения того, чтобы нейроны либо замолкали при падении синаптического возбуждения, либо не насыщались при увеличении возбуждения. В отсутствие стабилизирующих механизмов пластичность, зависящая от активности, может приводить нервную активность к насыщению или покою. Кроме того, по мере того, как клетки адаптируются к изменяющимся паттернам синаптического ввода, предположительно, общий баланс внутренней проводимости клетки должен поддерживаться для достижения надежного вывода (Daoudal and Debanne, 2003; Turrigiano and Nelson, 2004; Frick and Johnston, 2005). .Хотя эти регуляторные явления хорошо задокументированы, задействованные молекулярные и физиологические механизмы плохо изучены.
Этот мини-симпозиум дает возможность рассмотреть недавние работы о взаимосвязи между возбудимостью нейронов и тем, как это влияет на уникальные выходные данные и функции нейрона. Мы стремимся к расширению масштабов анализа, начиная с экспрессии отдельных генов и заканчивая более широким межклеточным воздействием модуляторов на возбудимость клеток.Сначала мы сосредоточимся на том, как события транскрипции связывают геном с возбудимостью нейронов, исследуя количественные уровни экспрессии генов, поскольку они связаны с функциональной идентичностью отдельных нейронов. Это включает фокусную выборку экспрессии ионных каналов путем измерения уровней мРНК для небольшого количества генов каналов, участвующих в собственной возбудимости. Затем это расширяется, чтобы рассмотреть полногеномный скрининг различий в экспрессии генов, коррелированных с идентичностью нейрональных клеток, и то, как это профилирование экспрессии может быть применено для понимания типичных, а также патологических состояний возбудимости нейронов.Наконец, мы исследуем концепции, выходящие за рамки экспрессии генов, связанные с клеточной возбудимостью и ее ролью в определении идентичности клеток, включая внутриклеточные посттрансляционные влияния и межклеточные нейромодулирующие эффекты на врожденную возбудимость.
Экспрессия ионных каналов, возбудимость и функциональная идентичность нейронов
Одним из возможных механизмов стабилизации возбудимости нейронов является зависимая от активности регуляция экспрессии ионного канала, которая противодействует изменениям в синаптическом входе.Напр., В моторных нейронах Drosophila , потенциал-зависимый натриевый ток ( I Na ) изменяется, чтобы компенсировать измененные уровни синаптического возбуждения (Mee et al., 2004). В отсутствие синаптического возбуждения I Na значительно повышается, тогда как повышенное возбуждение приводит к снижению I Na (рис. 1 A ). Измерение уровней паралитической мРНК ( para ), которая кодирует единственный потенциал-управляемый канал Na + в этих нейронах, показывает, что регуляция I Na достигается за счет контроля пара мРНК уровень (рис.1 B ). Изменения в мРНК, вероятно, могут быть приписаны, по крайней мере частично, зависимой от активности репрессии трансляции известным репрессором трансляции pumilio ( pum ). pum и необходимы, и достаточны для зависимых от активности изменений, наблюдаемых в мРНК para у различных мутантов синаптической активности (Рис. 1 C ). Анализ последовательности транскрипта para показывает, что он содержит специфические мотивы, называемые нано-ответными элементами, в его множественных 5′-нетранслируемых областях.Ранее было показано, что эти мотивы необходимы для связывания белка Pum с РНК hunchback ( hb ). Связывание Pum с hb является начальным этапом, который приводит к репрессии трансляции этого транскрипта (Baines, 2005). Присутствие этих мотивов в para указывает на возможное прямое взаимодействие между Pum и мРНК para , что приводит к подавлению трансляции и, возможно, деградации транскрипта para . Таким образом, эта работа обеспечивает детальное понимание регуляции экспрессии одноканального белка, para , и его конечного влияния на клеточную возбудимость.
Рисунок 1.
Воздействие синаптического возбуждения регулирует I Na и возбудимость мембран в мотонейронах Drosophila . A , Амплитуда управляемых напряжением I Na , зарегистрированных в мотонейронах Drosophila , обратно пропорциональна синаптическому возбуждению, которое получают эти нейроны. B . Обилие мРНК para в изолированной ЦНС значительно выше в аллеле потери функции pum bem .Для сравнения, сверхэкспрессия UAS (восходящая активирующая последовательность) — pum во всех нейронах ЦНС (1407 GAL4) достаточна для значительного снижения мРНК para . C , Возбудимость мембраны, измеренная как возбуждение потенциала действия, показывает значительное увеличение Pumilio bem (потеря функции) и значительное снижение после сверхэкспрессии UAS- pumilio (прирост — функция) соответственно. Скорость срабатывания потенциала действия определялась путем подачи постоянного тока (1–10 пА / 500 мс) с удерживающим потенциалом -60 мВ. A перепечатано из Baines and Pym (2006). B и C перепечатаны из Mee et al. (2004).
Хотя изменение собственной возбудимости может противодействовать изменениям в синаптическом входе, изменения вклада только одной ионной проводимости могут нарушить тонкий баланс многочисленных мембранных проводимостей, ответственных за пусковые свойства клетки. Недавняя работа показывает, что такая регуляция экспрессии ионных каналов (и в конечном итоге клеточной возбудимости) не происходит независимо для одиночных ионных каналов.Хотя уровни экспрессии для данного ионного канала могут варьироваться от двух до четырех раз в определенном классе нейронов (Schulz et al., 2006), между ионными каналами могут существовать некоторые фиксированные отношения, которые могут играть роль в стабилизации функционального нейронального выхода (MacLean et al. ., 2003; Schulz et al., 2006). Путем измерения уровней мРНК для шести различных ионных каналов от одних и тех же идентифицированных моторных нейронов стоматогастрального ганглия ракообразных недавние исследования демонстрируют, что несколько ионных каналов в одной клетке показывают коррелированные уровни экспрессии (D.J. Schulz, J.-M. Гоайярд и Э. Мардер, неопубликованные наблюдения). Например, в нейронах пилорического расширителя было обнаружено шесть различных значимых парных корреляций между этими типами каналов, что выявило очевидную четырехстороннюю корегуляцию между shal ( I A ), para ( I Na ), IH ( I H ) и BKKCa ( I K [Ca] ) мРНК. Более того, в шести исследованных различных индивидуально идентифицируемых типах клеток не было двух типов клеток, которые показали одинаковый набор уровней коррелированной экспрессии каналов.Эти результаты предполагают, что не только клетки компенсируют измененную возбудимость, но и каждый разный тип клеток имеет уникальный механизм, по крайней мере частично, зависящий от относительной распространенности экспрессии ионных каналов, с помощью которой генерируется и поддерживается их отдельный выход.
Выявление и понимание свойств уникальных классов нейронов с использованием полногеномных профилей экспрессии
Тот факт, что нет двух однозначно идентифицированных типов клеток, демонстрирующих одинаковый паттерн экспрессии среди шести различных ионных каналов, указывает на то, что функциональные различия между нейроном и его соседями являются результатом, по крайней мере, частично, различий в экспрессии генов.Был запущен амбициозный проект по использованию этих различий в экспрессии генов для внедрения систематического подхода к идентификации и классификации типов клеток в головном мозге млекопитающих (Nelson et al., 2006; Sugino et al., 2006). Используемая стратегия объединяет две мощные и относительно новые технологии: трансгенных мышей и микроматрицы (рис. 2). Генетически кодируемые маркеры, такие как зеленый флуоресцентный белок, теперь могут быть выборочно экспрессированы в сильно ограниченных популяциях нейронов с поразительной точностью.Это позволяет использовать их для электрофизиологических записей, чтобы оценить их собственные свойства возбудимости. Флуоресцентный маркер также позволяет очищать нейроны, чтобы мРНК можно было извлекать, амплифицировать и исследовать с помощью микрочипов. Результатом является всеобъемлющий профиль экспрессии в масштабе всего генома, который можно использовать в качестве индекса сходства между типами нейрональных клеток и, таким образом, можно надеяться, в качестве основы для систематической «нейрональной таксономии» (Sugino et al., 2006). Эти профили экспрессии также обеспечивают идентичность большого числа генов, специфичных к типу клеток, которые, вероятно, вносят вклад в различные функциональные идентичности различных типов нейрональных клеток.Среди них, конечно же, есть гены, кодирующие ионные каналы. Они служат отправной точкой для исследований роли отдельных ионных каналов в определении электрофизиологических фенотипов.
Фигура 2.
Мышей, у которых субпопуляции нейронов помечены генетически, используют для электрофизиологических записей и анализа микрочипов, специфичных для типа клеток, для получения коррелированного профиля возбуждающих свойств и экспрессии генов.
Эти концепции профилирования экспрессии уже используются для понимания нормальной функции нейронов и восприимчивости к патологии в нейронах с важными последствиями для здоровья человека — дофаминергических (DA) нейронах среднего мозга.В среднем мозге нейроны DA расположены в двух перекрывающихся ядрах, черном веществе (SN) и вентральной тегментальной области (VTA). Избирательная дегенерация или функциональная дисрегуляция DA нейронов причинно вовлечены в важные человеческие расстройства, такие как болезнь Паркинсона (БП), наркомания и шизофрения (Seamans and Yang, 2004; Moore et al., 2005; Hyman et al., 2006). . Комбинируя электрофизиологию отдельных клеток и профили экспрессии генов (рис.3 A ), недавняя работа подчеркнула возрастающую роль ионных каналов в патофизиологии системы среднего мозга DA (Liss et al., 2005). Уже в условиях физиологического контроля DA нейроны в SN и VTA обнаруживают множество различных электрофизиологических свойств, которые функционально коррелируют с дифференциальной экспрессией связанных субъединиц ионных каналов (для обзора см. Korotkova et al., 2004; Liss and Roeper 2004). Стробирование ионных каналов регулирует электрическую активность нейронов DA и, в свою очередь, их высвобождение дофамина (Cragg et al., 1997). Кроме того, было продемонстрировано, что активность нейронов имеет решающее значение для выживания нейронов SN DA при хроническом нейродегенеративном заболевании: токсины, вызывающие паркинсонизм (блокаторы митохондриального комплекса I ротенон и 1-метил-4-фенилпиридин), селективно активируют АТФ-чувствительный калий ( K-ATP) каналов (Nicols, 2006) в очень уязвимых нейронах SN DA, но не в более устойчивых нейронах VTA DA.Следовательно, нормальная спонтанная активность нейронов SN DA подавляется (Liss et al., 2005). Более высокие уровни экспрессии мРНК К-АТФ-каналов и более низкие уровни мРНК митохондриального разобщающего белка UCP-2 (Andrews et al., 2005) в нейронах SN DA коррелируют с зависимым от К-АТФ-каналом избирательным подавлением этих нейронов (рис. . 3 B ). Генетическая инактивация порообразующей субъединицы K-ATP-канала Kir6.2 полностью спасает высоко уязвимую популяцию SN DA в хроническом in vivo 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (MPTP) мышиная модель БП (рис.3 C ) (Liss et al., 2005). Текущая работа направлена на выявление механизмов, которые контролируют активность и дифференциальную уязвимость DA нейронов среднего мозга, выше и ниже каналов K-ATP, путем анализа экспрессии генов отдельных электрофизиологически охарактеризованных нейронов DA из SN и VTA с помощью стратегий микрочипов. Этот одноклеточный подход дополняет и улучшает специфичность недавних элегантных исследований микроматриц с использованием пулов микродиссектированных нейронов SN и VTA DA для глобального сравнения транскриптомов (Grimm et al., 2004; Чунг и др., 2005; Грин и др., 2005).
Рисунок 3.
Активность
К-АТФ-канала запускает избирательную дегенерацию нейронов SN DA. A , Схематический обзор анализа электрофизиологической функции и экспрессии генов отдельных дофаминергических нейронов (мышь / человек), сочетающий зажимание участка мозга (вставка, типичная спонтанная активность DA нейронов) или лазерная микродиссекция с профилированием экспрессии генов (обратная транскрипция) -ПЦР / микрочипы). Масштабные линейки 15 мкм. B , Дофаминергические нейроны в SN и VTA [маркированные иммуноокрашивателем тирозингидроксилазы (TH)] демонстрируют дифференциальную уязвимость в хронической мышиной модели МРТР PD. Указаны дифференциальные уровни мРНК субъединиц К-АТФ-канала и UCP2. C . Результаты количественной стереологии показали полное спасение высоко уязвимых нейронов SN DA в модели хронического MPTP PD у мышей с нокаутом K-ATP канала (Kir6.2 — / -; слева). Напротив, вызванная МРТР умеренная потеря нейронов VTA DA не зависела от присутствия (+ / +) или отсутствия (- / -) каналов K-ATP (справа).
Посттрансляционные события и регуляция идентичности нейронов посредством клеточной возбудимости
Хотя понимание экспрессии генов, участвующих в клеточной возбудимости и функциональной идентичности, продолжает проливать свет на фундаментальные вопросы нейрональной функции, анализ уровня экспрессии выявляет лишь небольшую часть механизмов функционального выхода клетки. Посттрансляционная модификация, особенно фосфорилирование, может быстро изменить свойства данного ионного канала и, следовательно, радикально изменить электрофизиологические характеристики клетки.Ярким примером этого типа регуляции является управляемый напряжением канал K + Kv2.1, который обеспечивает соматодендритные токи I K в центральных нейронах (Murakoshi and Trimmer, 1999). Kv2.1 экспрессируется в больших (~ 2 мкм в диаметре) кластерах на соматах и проксимальных дендритах основных пирамидных нейронов (Lim et al., 2000), а также в высокой степени и конститутивно фосфорилируется (Рис. ) (Park et al., 2006). Из-за высокого порога активации, зависящей от напряжения (рис.4 C ), Kv2.1, по-видимому, не играет заметной роли в реполяризации единичных потенциалов действия (Du et al., 2000; Malin and Nerbonne, 2002). Кроме того, эта уникальная характеристика Kv2.1 претерпевает кардинальные изменения при различных патологических состояниях. На моделях приступов было продемонстрировано, что результирующий приток Ca 2+ приводит к драматическому дефосфорилированию Kv2.1, дисперсии кластеров Kv2.1 и большому сдвигу влево кривой активации напряжения канала Kv2.1 через кальциневрин- зависимые механизмы (рис.4 C ) (Misonou et al., 2004). Kv2.1 затем может вносить свой вклад в реполяризацию мембранных потенциалов, что приводит к подавлению общей возбудимости нейронов. Более того, кратковременная ишемия вызывает аналогичную модуляцию Kv2.1 (Fig. 4 C ), вызванную не притоком Ca 2+ , а внутриклеточным высвобождением Ca 2+ из митохондрий (Misonou et al., 2005). Эти находки ясно показывают, что в ответ на гипервозбудимые состояния нейроны используют специфические механизмы для модуляции Kv2.1 посредством событий фосфорилирования, так что каналы Kv2.1 становятся более активными и гомеостатически подавляют возбудимость нейронов. Это может представлять собой ключевой, но ранее неизвестный фактор защиты от гипервозбудимости, вызванной эпилептическими припадками и ишемией мозга.
Рисунок 4.
A , Дефосфорилирование Kv2.1, вызванное судорогами и ишемией. Крыс подвергали либо каинат-индуцированным непрерывным припадкам (каинат), либо ишемии мозга, индуцированной CO 2 (ишемия).Готовили полную мозговую мембрану, и фракцию обрабатывали in vitro щелочной фосфатазой (AP) для полного дефосфорилирования Kv2.1. Стрелка указывает на сильно фосфорилированный Kv2.1, а острие стрелки указывает на полностью дефосфорилированный Kv2.1. Цифры слева обозначают стандарты молекулярной массы. B , Дисперсия кластеров Kv2.1 в головном мозге вследствие ишемии. Срезы мозга контрольных и ишемизированных крыс окрашивали специфическим антителом против Kv2.1. Изображения показывают пирамидные нейроны в коре головного мозга.Следует отметить, что судороги, вызванные каинатом, также приводили к рассеиванию кластеров Kv2.1. Масштабная линейка 10 мкм. C , Изменения биофизических свойств I K /Kv2.1 в результате стимуляции глутамата и ишемии в культивируемых нейронах. I K токи регистрировали в культивированном нейроне гиппокампа при фиксации напряжения всей клетки. Показаны полумаксимальный потенциал активации мембраны ( G 1/2 ) и наклон кривой активации (среднее значение ± стандартная ошибка среднего).Значения взяты из Misonou et al. (2004, 2005).
Помимо внутренних свойств и клеточной возбудимости: нейропептидомика и влияние модулирующих веществ на идентичность нейронов
Понимание внутренних свойств отдельной клетки способствует раскрытию механизмов, с помощью которых она генерирует уникальный результат, но in vivo возбудимость клетки также формируется ее внеклеточной средой. В частности, возбудимость клеток часто подвергается обширной нейромодуляции.Следовательно, фундаментальное понимание того, как отдельная клетка производит уникальный функциональный результат, требует не только понимания ее внутренней плотности каналов и последующих событий внутриклеточного фосфорилирования, но также идентификации полного набора нейромодуляторов, действующих на нее. Нейропептиды — это модулирующие вещества, которые могут действовать через дивергентные и конвергентные пути, обеспечивая баланс между стабильностью и гибкостью отдельного нейрона и сети (сетей), к которой он принадлежит (Brezina and Weiss, 1997; Nusbaum et al., 2001; Свенсен и Мардер, 2001). Ключом к пониманию этого баланса является раскрытие механизмов того, как богатый репертуар нейропептидов может точно настроить четко определенные нейронные схемы для получения нескольких выходных сигналов на клеточном и сетевом уровнях. Сети, обнаруженные в стоматогастральной нервной системе ракообразных, широко модулируются нейромодуляторами, высвобождаемыми проекционными нейронами, а также пептидными гормонами, секретируемыми нейрогемными органами. Используя высокочувствительный анализ пептидов на основе масс-спектрометрии и стратегию секвенирования de novo (рис.5 A ) было обнаружено большое количество новых пептидов, что показало, что даже относительно простая нейронная сеть содержит неожиданно богатое разнообразие нейропептидов (Fu and Li, 2005; Fu et al., 2005a, b; DeKeyser and Li , 2006). Используя комбинированный масс-спектрометрический и электрофизиологический подход, эта работа предоставляет первое свидетельство того, что различные члены хорошо известного семейства FMRFamide (Phe-Met-Arg-Phe-амид) -подобных пептидов демонстрируют различную чувствительность к активности внеклеточной пептидазы (рис.5 B ), которые могут обеспечивать другой механизм модуляции возбудимости конкретных нейронов в нейронной сети (Cruz-Bermudez et al., 2006). Такие комбинированные пептидомические и физиологические исследования помогут выяснить функциональную роль нейропептидов в пластичности нейронов и нейронных сетей и продвинуть наше понимание полного набора механизмов, вносящих вклад в уникальную идентичность и производительность любого данного нейрона в нервной системе.
Рисунок 5.
Разработка пептидомного подхода на основе масс-спектрометрии для понимания функциональных последствий множественности нейропептидов. A , Обзор основанной на масс-спектрометрии стратегии открытия и характеристики нейропептидов. B , Дифференциальная деградация трех пептидов FLRFamide (Phe-Leu-Arg-Phe-Nh3) пептидазой, находящейся в органе перикарда, отслеживаемая с помощью масс-спектрометрии с лазерной десорбцией / ионизацией с матричным преобразованием Фурье. A перепечатано из работы ДеКейзера и Ли (2006). B адаптировано из Cruz-Bermudez et al.(2006). МС — масс-спектрометрия; MALDI, матричная лазерная десорбция / ионизация; ESI, ионизация электрораспылением; RT — обратная транскрипция; ЦМ ПО, Рак магистр перикардиального органа.
Заключение
Функциональная специализация многих различных классов нейронов, составляющих нервную систему, в значительной степени определяется конкретными наборами и относительным количеством ионных каналов, которые экспрессируют нейроны. Именно эти ионные каналы определяют характеристики мембраны, через которые каждый тип нейрона переводит свой синаптический вход в аксональный выход, и в конечном итоге определяют роль отдельной клетки в нейронной сети.Цель этого мини-симпозиума состояла в том, чтобы выделить исследования, которые проливают свет на взаимосвязь между возбудимостью нейронов и идентичностью нейронов, в надежде понять не только то, что придает клетке ее уникальную идентичность, но и лежащие в основе клеточные механизмы, которые позволяют клетке поддерживать эта идентичность перед лицом изменения синаптического входа.
МЕМБРАННЫЙ ПОТЕНЦИАЛ
МЕМБРАННЫЙ ПОТЕНЦИАЛ
В ячейке мы используем те же принципы, что и двухкамерная модель, за исключением того, что мы изначально используем энергию или работаем, чтобы отделить ионы друг от друга (подумайте о нашем эксперименте с воздушным шаром и волосами).Эта энергия поступает в виде насоса Na + / K + ATPase. Этот насос перемещает три иона Na + из ячейки и два иона K + в ячейку (см. Рисунок ниже), используя при этом АТФ (энергию).
Изображение создано в BYU-I JH, 2013.
Схема клетки, устанавливающей мембранный потенциал покоя. Показаны изображения канала K +, который позволяет перемещать K + из клетки, закрытого канала Na +, который предотвращает движение Na + в клетку, и насоса Na + / K + АТФазы, который перемещает три иона Na + из клетки.
Этот насос находится почти в каждой клетке тела. Насос создает градиент концентрации как для K + , так и для Na + . Это вызывает гораздо более высокую концентрацию K + внутри клетки и гораздо более высокую концентрацию Na + вне клетки. Это приводит к очень большому градиенту концентрации для K + , чтобы покинуть ячейку, и очень большому градиенту концентрации для Na + , чтобы войти в ячейку.Однако клеточная мембрана в нормальных условиях не пропускает Na + , но с мембраной все в порядке, если K + попытается уйти. Говоря более физиологически, мембрана содержит канальные белки для K + и канальные белки для Na + , однако большинство каналов закрыты для Na + и открыты для K + , в результате чего мембрана имеет 50- В 100 раз более проницаемая для K + , чем для Na + в условиях покоя.
Мембранный потенциал покоя
Таким образом, из-за большого градиента концентрации K + он начнет выходить из клетки путем диффузии. Когда K + покидает клетку, он оставляет отрицательные заряды, как показано в нашей модели. В клетке большая часть эффекта одинокого отрицательного заряда исходит от отрицательно заряженных белков. Результат тот же; внутренняя часть клеточной мембраны начнет становиться отрицательной по отношению к внешней стороне мембраны.Когда мембрана достигает состояния равновесия, мы называем это состояние покоящимся мембранным потенциалом , и мы можем фактически измерить отрицательный заряд внутри клетки. Мы выражаем заряд мембраны в милливольтах.
Мембранные потенциалы и возбудимые ткани
И что? Кого волнует, что внутри клетки отрицательные? Обратите внимание на слово «потенциал». В этом состоянии клетка теперь имеет потенциал; или разделение заряда. Не все клетки имеют одинаковый потенциал.Было показано, что все ячейки имеют разницу зарядов между внутренней и внешней частью ячейки. Размер этого заряда отличается от ячейки к ячейке. Например, мембранный потенциал покоя нейрона составляет -70 мВ. Хотя все ткани обладают мембранными потенциалами покоя, некоторые реагируют уникальным и предсказуемым образом, когда они стимулируются. Мы называем эти клетки возбудимыми. Возбудимые клетки имеют потенциалы покоя от -50 мВ до -85 мВ, в то время как невозбудимые клетки имеют потенциалы от -5 мВ до -10 мВ.Возбудимые клетки включают нейроны и клетки скелетных мышц, а невозбудимые клетки включают эритроциты. Не требуется большого воображения, чтобы увидеть, как нейроны и клетки скелетных мышц могут быть намного более захватывающими, чем эритроциты.
Итак, как именно мембранный потенциал вызывает возбудимость? Прежде чем мы сможем полностью понять эту концепцию, нам нужно еще раз вернуться к концепции белков, в частности, тех белков, которые находятся в клеточной мембране. Во-первых, что делают белки в мембране? Помните, что мембраны состоят из фосфолипидов с гидрофильными концами (люблю воду) и гидрофобными концами (ненавидите воду).Из-за природы фосфолипидов клеточная мембрана практически водонепроницаема. Фактически, это в основном доказательство того, что большинство вещей не может преодолеть барьер, образованный фосфолипидами. Однако мы видели, что в мембранах клеток встроены белки, которые могут образовывать закрытые каналы для веществ, чтобы покидать клетки или входить в них, например канал K + .
Белковые каналы
Канал K + представляет собой пример белка, который расположен в мембране так, что действует как канал для прохождения K + .Большинство канальных белков очень специфичны и пропускают только определенные вещи. На простейшем уровне белковые каналы бывают двух основных типов; те, которые открыты все время ( каналов утечки, ), и те, которые закрыты большую часть времени ( закрытые, ). Закрытые каналы могут быть открыты несколькими различными типами стимулов. Если они открываются в ответ на электрические изменения, они называются потенциалозависимыми ионными каналами . Те, которые открываются в ответ на механическую стимуляцию, представляют собой механически управляемых ионных каналов , а те, которые открываются в ответ на химический стимулятор, называются химически управляемыми, или лигандными ионными каналами .K + может перемещаться через мембрану через каналы утечки или закрытые каналы. Na + также может перемещаться по обоим типам каналов, но в большинстве ячеек имеется небольшое количество каналов утечки для Na + и большое количество закрытых каналов для Na + . Таким образом, в нормальных условиях покоя Na + имеет очень большой градиент концентрации для входа в клетку, но он не может войти, потому что канал белка для натрия закрыт. Фактически, для большинства ионов дело в том, что их специфический белковый канал большую часть времени закрыт.
Активация стробированных каналов
Итак, что определяет, будет ли данный канал закрыт или открыт в ответ на данный стимул (например, напряжение, механический или лиганд)? Белки имеют много возможных форм или конформаций, которые определяются способом расположения их аминокислот. Рассмотрим, например, следующий гипотетический канал.
Изображение создано в BYU-I, автор: JH, 2013.
Изображение стробированного по напряжению канала. Это изображение показывает, как заряды аминокислот могут притягиваться или отталкиваться «мембранным потенциалом» и вносить вклад в открытую или закрытую конформацию «ворот».
Представьте себе, что конформация белка такова, что он действует как трубка через клеточную мембрану, но имеет две двери: дверь вверху, которая открывается во внеклеточный отсек, и дверь внизу, которая открывается в направлении внутриклеточного отсека.
Теперь предположим, что каждая дверная часть белка имеет чистый отрицательный заряд на кончике напротив петли. В условиях покоя кончик внутриклеточной двери будет отталкиваться отрицательными зарядами, но кончик внешней двери будет притягиваться положительными зарядами. Таким образом, в состоянии покоя верхняя дверь будет закрыта, а нижняя — открытой. Если, однако, мы могли бы хоть немного изменить заряд на мембране, то мы могли бы повлиять на конформацию белка.
Если заряд был изменен так, что внутренняя часть внезапно стала менее отрицательной (см. Рисунок ниже; представлена положительными зарядами), а внешняя — менее положительной (см. Рисунок ниже; представлена отрицательными зарядами), то двери открылись бы, а внешняя сторона открылась бы. , и внутренняя часть закроется, но в период между открытием и закрытием дверей канал будет открыт.
Изображение создано в BYU-I, автор: JH, 2013.
Изображение стробированного по напряжению канала, который «открылся» вверху, когда мембранный потенциал переключается на положительный снаружи. Обратите внимание на то, как ворота изнутри будут легче закрываться.
Если канал был проницаем для Na + , то Na + мог бы пройти через канал на короткое время. Вы не поверите, но именно кратковременный момент прохождения Na + через мембрану является основой возбудимости.Наша гипотетическая модель является примером канала с ограничением по напряжению. Мы называем это потенциометрией, потому что ворота (двери) белка реагируют на изменения напряжения или заряда (движение ионов) в мембране.
Движение ионов через белковые каналы
Что происходит, когда открывается нормально закрытый канал? Когда канал открывается, даже если это происходит на очень короткий период времени (менее 0,5 мсек), это позволяет конкретному иону перемещаться через мембрану.Что происходит с клеткой в течение этого «открытого» времени, зависит от типа иона и направления движения. Например, поскольку K + находится на высоком уровне внутри клетки, направление движения, основанное на градиенте концентрации, будет наружу или в сторону внеклеточного пространства. Так как K + — положительно заряженный ион, перемещение большего количества K + приведет к потере положительных зарядов; следовательно, ячейка станет еще более отрицательной. Но разве K + уже не находились в равновесии? Почему бы движение K + изменилось, если бы оно уже было в равновесии, просто открыв больше каналов? Итак, равновесие K + было основано на проницаемости мембраны или количестве открытых каналов.При открытии большего количества каналов K + будет перемещаться до тех пор, пока не установится новое равновесие относительно электрохимического градиента. Диффузия начнется до тех пор, пока не установится новый электрический градиент, противодействующий химическому градиенту. Таким образом, внутренняя часть ячейки станет более отрицательной из-за повышенного электрохимического градиента.
Еще один ион, который может вызвать более отрицательный мембранный потенциал, — это ион Cl — . В отличие от K + , концентрация Cl — является максимальной на внешней стороне ячейки, поэтому открытие канала Cl — позволит Cl — диффундировать в ячейку, что также делает ячейку более отрицательный.Противоположное верно для Na + и Ca ++ , оба из которых являются положительными ионами и имеют максимальную концентрацию вне клетки. Таким образом, открытие каналов для Na + или Ca ++ приведет к тому, что внутренняя часть клетки станет более положительной по мере продвижения этих катионов в клетку. В следующей таблице показаны относительные количества ионов (мэкв / л) и их распределение во внеклеточной и внутриклеточной жидкости.
Ион | Внеклеточная жидкость | Внутриклеточная жидкость |
|---|---|---|
Na + | 142 | 10 |
К + | 4 | 140 |
Ca ++ | 2.4 | 0,0001 |
мг ++ | 1,2 | 58 |
Cl- | 103 | 4 |
HCO3- | 28 | 10 |
** Вы можете использовать кнопки ниже, чтобы перейти к следующему или предыдущему чтению в этом модуле **
Распечатать эту страницу
Пластичность и стабильность нейронального выхода за счет изменения внутренней возбудимости: важно то, что находится внутри
РЕЗЮМЕ
Перед нервной системой стоит чрезвычайно сложная задача.Он должен быть гибким,
как во время развития, так и во взрослой жизни, чтобы он мог реагировать на различные
требований окружающей среды и производят адаптивное поведение. В то же время
нервная система должна быть стабильной, чтобы нейронные цепи, производящие
функция поведения на протяжении всей жизни животного, и это меняется
произведенный обучением выносить. Мы только начинаем понимать, как нейронные
сети обеспечивают баланс между изменением отдельных нейронов во имя
пластичность, сохраняя при этом долгосрочную стабильность функции нервной системы.Баланс этой пластичности и устойчивости в нейросетях несомненно
играет решающую роль в нормальном функционировании нервной системы. В то время как
механизмы синаптической пластичности в прошлом широко изучались
три десятилетия, только в последнее время все больше внимания уделяется
пластичность внутренней возбудимости как ключевого игрока нейронной сети
функция. В этом обзоре основное внимание будет уделено этой новой области исследований, которая
несомненно внесет большой вклад в наше понимание
функциональность нервной системы.
Введение
Внутренняя возбудимость относится к склонности нейрона к действию огня.
потенциалов при воздействии входного сигнала, будь то пресинаптическая активность или
прямой ввод от определенной сенсорной модальности. Другими словами, внутренняя
возбудимость нейронов отвечает за трансляцию синаптического входа
к конкретной выходной функции данного нейрона. Возбудимость нейронов
напрямую связано с набором ионных каналов, вставленных в мембрану
клетки, а также биохимические свойства и кинетику тех
каналы.Из-за их фундаментальной роли в генерации нейронов
Неудивительно, что изменения свойств, пространственного распределения или
обилие этих ионных каналов может привести к значительной пластичности
нейроны и сети, к которым они принадлежат.
Пластичность собственной возбудимости может играть несколько важных ролей в
функционирующая нервная система. Например, увеличение вероятности того, что
потенциал действия будет запускаться суммированными синаптическими входами — это de
facto механизм для усиления связей между ячейками независимо
синаптической силы (рис.1А).
Таким образом, механизмы, которые изменяют возбудимость нейронов, могут привести к пластичности
ответы на синаптическую стимуляцию, в конечном итоге влияющие на такие процессы, как
обучение, память и другие формы нейронных
пластичность.
В качестве альтернативы, изменения собственной возбудимости также могут иметь
стабилизирующее влияние на нервную функцию. Некоторые нейроны могут реагировать на изменения
в синаптическом входе или эндогенной активности, изменяя их возбудимость до
поддерживать заданную схему или темп стрельбы
(Инжир.1Б). Например,
нейрон водителя ритма, который испытывает снижение синаптического возбуждения, может
самостоятельно повышать собственную возбудимость за счет активации деполяризации
проводимости для поддержания фиксированного уровня выходной мощности. Эта
«гомеостатическая пластичность» в последнее время рассматривается как механизм
стабилизация нейрональной функции.
Наконец, возможно, что изменения происходят во внутренних свойствах
нейроны в сетях с нарушенной иннервацией в результате травмы или
болезнь.Такие изменения могут привести к зависимым от активности изменениям в
внутренние свойства ячеек в этих сетях, которые затем продолжают формировать
функционально разные, изолированные сети. Непонятно, какие долгосрочные
эффекты изменения возбудимости находятся в этих сетях. Однако как наши
ориентированы на лечение таких проблем, как травма спинного мозга
к восстановлению контакта между высшими системами и периферийным двигателем
сетей, нам следует понять, как были
изменено в результате лишения нисходящих входов.
Именно эти три аспекта пластичности нейрональной возбудимости у зрелых
нервные системы, о которых пойдет речь в этом обзоре: длительная потенциация
и снижение собственной возбудимости, гомеостатической пластичности нейронов
возбудимость и изменения возбудимости после нарушения афферентных
ввод. Следует отметить, что большая пластичность в собственном
свойства обнаруживаются в развивающейся нервной системе (см.
Муди и Босма, 2005). Эта
аспект развития истории, хотя и имеет большое значение, выходит за рамки
объем этого обзора.
Рисунок 1.
Примеры пластичности внутренней возбудимости нейронов. (A) Диаграмма
иллюстрируя концепцию потенцирования собственной возбудимости. В
круги представляют два разных нейрона, связанных возбуждающим синапсом
(треугольник). В случае потенцирования возбудимости одна форма
пластичность внутренних свойств нейронов, активность в пресинаптических
нейрон потенцирует связь с постсинаптическим нейроном. Эта
потенцирование является результатом повышения общей возбудимости
постсинаптический нейрон, независимый от изменений синаптической силы.Один возможный
Механизмом этого изменения возбудимости является снижение потенциала действия
порог. Результатом этой повышенной возбудимости является увеличение
функция ввода-вывода постсинаптической клетки: вызывается больше спайков
постсинаптически для того же количества пресинаптического ввода. Это приводит к
de facto увеличение синаптической силы опосредовано изменениями в
собственная возбудимость постсинаптического нейрона. Примеры такого рода
пластичность были недавно опубликованы
(Кадмор и Турриджиано, 2004;
Ли и др., 2004;
Сюй и др., 2005). (B) Диаграмма
иллюстрируя концепцию компенсаторных изменений возбудимости, ведущих к
сохраненный нейрональный выход. В этом случае постсинаптический нейрон поддерживает
постоянный уровень пиковой активности в результате компенсаторного снижения
возбудимость, вызванная повышенной пресинаптической активностью. Результат
постоянно поддерживаемый уровень пиковой активности в постсинаптической клетке,
что может быть результатом повышенного порога потенциала действия, для
пример.Примеры такой пластичности см. В последних публикациях.
(Aptowicz et al., 2004;
Брикли и др., 2001;
van Welie et al., 2004).
Обучение и долгосрочное потенцирование и подавление внутренних
возбудимость
Синаптическая пластичность и долгосрочное изменение синаптической прочности были
в основе исследований клеточных механизмов обучения и памяти
в течение трех десятилетий. Тем не менее, хотя синаптическая активность отвечает за
передача информации между нейронами, «решение» о том, что с ними делать.
эта информация является результатом интегрированной активности дендритов и
сома и, в конечном итоге, генерация (или нет) потенциалов действия в спайке
зона инициирования.Следовательно, внутренняя возбудимость нейрона имеет решающее значение.
для определения конечного выхода любого синаптического входа. Таким образом, вопрос
становится ли генерация потенциала действия статическим компонентом синаптического
пропускная способность, не влияющая на механизмы обучения и памяти, или
зависимые от опыта изменения нейрональной активности также могут быть результатом
модификация собственной возбудимости.
Одно из лучших доказательств того, что обучение может частично быть результатом
изменения в возбудимости нейронов происходят из парадигм обусловливания.Один из
первые примеры пластичности собственной возбудимости как функции
поведенческое обучение (и предположительно через синаптический привод из-за этого
тренировка) описан у голожаберного моллюска Hermissenda
crassicornis . Стойкое повышение собственной возбудимости типа B
фоторецепторы могут быть вызваны через сочетание света и вращения
стимулы (Алкон, 1984). Эта
изменение связано, по крайней мере частично, с уменьшением переходного процесса K +
ток ( I A ).Снижение гиперполяризации K +
токи, такие как I A , повышают возбудимость нейронов.
Это повышение возбудимости фоторецепторов Hermissenda сохраняется.
в течение нескольких дней или недель, таким образом, может иметь долгосрочное влияние на обучение и память.
Подобные изменения собственной возбудимости известны у других беспозвоночных.
парадигмы кондиционирования, такие как условное закрытие пневмостома у улитки
Helix (Гайнутдинов и др.,
1998) и условное удаление жабр / сифона в Aplysia
(Антонов и др., 2001).
Хотя эти соответствующие примеры изменений внутренней возбудимости
предполагают, что этот механизм играет роль в обучении, неясно,
изменения возбудимости представляют собой функциональную часть следа памяти или
просто играют вспомогательную роль в формировании памяти. Например, во время
кондиционирование моргания у кролика ( Oryctolagus cuniculus ), затяжка
воздуха, который вызывает рефлекторное моргание глаз, сочетается с нейтральным раздражителем (например,
как звуковой сигнал) до тех пор, пока нейтральный раздражитель сам не сможет вызвать моргание
рефлекс.Пирамидные клетки в областях СА1 и СА3 гиппокампа обнаруживают изменения.
в собственной возбудимости через 24 ч после этого кондиционирования, включая повышенную
скачок в ответ на подачу тока и уменьшение амплитуды
постгиперполяризация, вызванная всплесками потенциала действия
(Мойер младший и др., 1996;
Томпсон и др., 1996). Еще
через 7 дней, в то время как следы в памяти от кондиционирования остаются нетронутыми (и
действительно может длиться месяцами), изменения возбудимости регистрируются через 24 ч.
больше не обнаруживаются (Moyer, Jr et al.
al., 1996). Эти результаты предполагают, по крайней мере, в этой системе, что
повышение возбудимости не является частью самого следа памяти, а
скорее может способствовать формированию следа синаптической памяти за счет увеличения
вероятность индукции синаптической долговременной потенциации в
гиппокамп или другое место (Чжан и
Linden, 2003).
За последние 5 лет появилось много сообщений об увеличении возбудимости нейронов в
ответ на высокочастотную синаптическую стимуляцию. Этот феномен,
все вместе известные как долгосрочное усиление собственной возбудимости
(LTP-IE), был обнаружен в клетках зрительной коры V слоя.
(Кадмор и Турриджиано, 2004 г.),
гранулярные клетки (Armano et al.,
2000) и глубокие ядерные нейроны мозжечка
(Айзенман и Линден, 2000 г.),
и нейроны CA1 гиппокампа (Даудал и
Дебанн, 2003; Сюй и др.,
2005), и это лишь некоторые из них. В последнее время длительная депрессия внутреннего
о возбудимости также сообщалось в культивируемых нейронах и клетках гиппокампа.
соматосенсорной коры (Li et al.,
2004 г.). Механизмы изменения возбудимости следующие:
варьировались в зависимости от вовлеченных типов клеток. Эти механизмы включают снижение
величина и кинетика токов K + типа А
(Фрик и др., 2004), медленно
инактивация токов K + (Li et al.
др., 2004), кальций-активированные токи K +
(Санчес-Андрес и Алкон,
1991) и напряжением Na + токов
(Xu et al., 2005) и являются
считается, что действует посредством опосредованной кальцием активации путей фосфорилирования
(Кадмор и Турриджиано, 2004;
Ли и др., 2004;
Сюй и др., 2005).
В то время как открытие многочисленных сайтов и механизмов LTP-IE продолжило
предположили, что этот феномен играет ключевую роль в нейронной пластичности, что
крайне необходимы исследования функциональных последствий этого
пластичность.В дополнение к вышеупомянутым парадигмам обусловливания, одна из
лучшие примеры функциональной роли в регуляции внутренних нейронных
возбудимость возникает из-за работы в области зрительного нерва головастиков Xenopus
(см. рис. 2). Свободно
плавающих головастиков, постоянный режим зрительной стимуляции увеличивает
возбудимость нейронов тектума зрительного нерва
(Айзенман и др., 2003)
(Рис. 2А). Это увеличение
Возбудимость обусловлена, по крайней мере частично, увеличением пиковой амплитуды
напряжение-управляемый ток Na + (рис.2B), и коррелирует с (и, возможно, инициировано)
последующее снижение синаптического диска на эти клетки
(Айзенман и др., 2002). В
Конечным результатом является общий сдвиг во взаимоотношениях ввода-вывода в этих
тектальные нейроны: тектальные нейроны с повышенной возбудимостью проявляют повышенную
реакции на временные когерентные (то есть всплески) стимулы
(Айзенман и др., 2003).
Кроме того, тектальные нейроны интактных животных, подвергшихся этой стимуляции
протоколы более чувствительны к последующим визуальным стимулам, и все же эти клетки
не проявляют изменений в спонтанной активности
(Инжир.2С). Эти данные предполагают
что это повышение возбудимости нейронов играет функциональную роль за счет
увеличение отношения сигнал / шум для визуальных стимулов и, таким образом, улучшение
Обнаружение стимула in vivo .
Гомеостатическая пластичность и собственная возбудимость
Регуляция собственной возбудимости может существовать параллельно с синаптической
пластичность и действуют согласованно, чтобы контролировать прохождение синаптических сигналов.
Но если учесть, что нейроны постоянно подвергаются различным
механизмов пластичности и модуляции, становится ясно, что при отсутствии
некоторой формы стабилизирующей активности клетки быстро будут вытеснены за пределы
параметры нормальной нейрональной функции.Тогда возникает вопрос: как сделать
клетки сохраняют гибкость, чтобы реагировать на изменения в окружающей среде, но
ограничить эту гибкость так, чтобы функционально значимый вывод
поддерживается?
Гомеостатические процессы широко распространены во всех живых системах, и
нервная система не исключение. Отдельные нейроны, а также нейроны
сети должны поддерживать уровень возбудимости и связи, чтобы гарантировать, что
достигается согласованный функциональный результат. Доказательства такого гомеостатического
механизмов в нейронах и нейронных цепях неуклонно растет
(Дэвис и Безпрозванный, 2001;
Turrigiano, 1999;
Turrigiano and Nelson, 2004).Например, у мышей и у Drosophila нервно-мышечное соединение
может компенсировать снижение постсинаптической возбудимости за счет увеличения
высвобождение пресинаптического медиатора для поддержания нормального уровня мышц
деполяризация (Petersen et al.,
1997; Sandrock, Jr et al.,
1997). Однако только совсем недавно гомеостатические механизмы
участвующие в контроле собственной возбудимости, были исследованы в
деталь. Есть две линии доказательств, подтверждающих идею о том, что ионный
проводимости поддерживаются гомеостатическим образом для стабилизации
возбудимость данного нейрона: измерения эндогенной мембраны
проводимости и манипуляции, которые изменяют возбудимость нейрона.
Часто предполагается, что все нейроны одного типа клеток, производящие
аналогичный результат имеет идентичные внутренние свойства, как внутри животного, так и
между людьми. Однако недавние теоретические работы утверждали, что подобные
активность нейронов может быть получена из различных комбинаций мембранных
проводимости (Golowasch et al.,
2002; Лю и др.,
1998; Prinz et al.,
2003; Prinz et al.,
2004 г.). Эти теоретические исследования поддержаны недавно
опубликованные работы по измерению изменчивости проводимости мембран и
соответствующие уровни экспрессии ионных каналов в отдельных идентифицированных нейронах
стоматогастральный ганглий краба (Schulz
и другие., 2006). В нейронах латерального пилорического отдела (LP) от трех до четырех раз.
изменчивость между животными видна для трех потоков калия, измеренных в
двухэлектродный фиксатор напряжения (рис.
3B), хотя характер возбуждения нейронов LP очень высок.
сохраняется от животного к животному (рис.
3А). Эти же нейроны показали аналогичную вариабельность в
Уровни мРНК для ионных каналов, соответствующих этим проводимостям
(Рис. 3C), демонстрируя, что
эта вариабельность существует на нескольких функциональных уровнях, а не просто
артефакт «шума» при записи фиксатора напряжения
(Инжир.3D). Предположительно
дисперсия, наблюдаемая в этих нейронах, частично отражает результат
пластичность, зависящая от опыта. Следовательно, эта изменчивость может быть
проявление компенсаторных механизмов, позволяющих нервной системе
поддерживать стабильную функцию с течением времени.
Рис 2.
Визуально управляемая регуляция собственной нейрональной возбудимости в
Xenopus тектальные нейроны улучшают обнаружение стимулов in vivo .
(A) Тектальные нейроны головастиков, подвергшихся действию протокола визуальной стимуляции, показывают
повышенная возбудимость в ответ на введенный деполяризующий ток.Осталось:
отношения ввода-вывода в ответ на деполяризации прямоугольных импульсов
различной амплитуды. Нейроны зрительно стимулированных животных (открытые треугольники;
N = 25) показывают значительно большую пиковую активность в ответ на
подаваемый ток, чем у элементов управления (закрашенные кружки; Н, = 20). Правильно:
репрезентативные записи этих нейронов, показывающие различия в
ответ на текущий впрыск. (B) Повышение возбудимости тектальных
нейроны являются результатом изменения напряжения в зависимости Na +
токи.Na + токов (слева), но не K + токов
(справа) показывают значительное увеличение пиковой амплитуды визуально стимулированных
животные. Увеличение этих токов Na + , которые деполяризуют
и возбуждающий, может объяснить увеличение возбудимости, наблюдаемое при
визуально стимулированные головастики. Открытые символы обозначают записи визуально
стимулированные нейроны ( N = 46), а закрытые символы — элементы управления
( N = 25). K + токи: переходные, переходные; суровый, устойчивый;
Ca 2+ токи: I — плато.(C) Повышенная возбудимость
тектальные нейроны улучшают обнаружение визуальных стимулов у полуинтактных головастиков.
Записи визуально вызванных потенциалов поля производились с тектума в
контрольные и стимулированные головастики. Показанные записи представляют пять испытаний.
из контрольной клетки, и пять испытаний, записанных из клетки головастика
предварительно подвергнутые протоколу визуальной стимуляции. Нейрон из
зрительно стимулированное животное вырабатывает больше потенциалов действия, чем контрольное животное.
ответ на впоследствии предъявленный световой раздражитель (открытая стрелка), указывающий
что чувствительность к зрительным раздражителям повышена у головастиков с предыдущим
визуальная стимуляция.Рисунок адаптирован из Aizenman et al.
(Aizenman et al., 2003) и
воспроизводится с разрешения.
Также появляется все больше свидетельств экспериментов по манипулированию
возбудимость нейрона и поиск компенсаторных сдвигов в мембране
проводимости, которые позволяют нейрону поддерживать стабильные выходные свойства. В
нейроны стоматогастрального ганглия ракообразных, сверхэкспрессия
канал, ответственный за переходный процесс K + ток
( I A ) приводит к резкому увеличению измеримого
мембранный ток, но очень мало влияет на выход нейрона
(MacLean et al., 2005;
MacLean et al., 2003). Это
результат сопутствующего и компенсаторного увеличения
входящий ток, активированный гиперполяризацией ( I H ).
Интересно, что эта очевидная компенсация не является улицей с двусторонним движением:
сверхэкспрессия I H не сопровождается увеличением
I A , и впоследствии выходной сигнал нейрона изменяется
(Zhang et al., 2003). А
подобная компенсация, как полагают, происходит для кальциевых токов в базальных
нейроны переднего мозга (Etheredge et al.,
2005). Мутантные мыши с пониженным уровнем Ca против 2,1
функция каналов показывает относительно нормальные уровни общего кальциевого тока
плотности из-за активации функции кальциевых каналов Ca против 1. В
Фактически, способность нейронов увеличивать свою возбудимость в ответ на
снижение уровня возбуждения становится общепризнанным: напряжение стробируется
натриевые каналы активируются в культурах обоих срезов гиппокампа
(Aptowicz et al., 2004) и
мотонейроны Drosophila в ответ на депривацию активности
(Mee et al., 2004). Сотовая связь
также существуют механизмы, которые снижают возбудимость нейронов перед лицом
повышенный возбуждающий синаптический драйв (ван
Welie et al., 2004) или снижение ингибирующей синаптической активности
(Брикли и др., 2001).
Взятые вместе, эти результаты предполагают, что в дополнение ко многим формам
клеточная пластичность в нервной системе, которая допускает такие процессы, как
обучение и память, есть также механизмы, которые стабилизируют
и поддерживать функцию нервной системы с течением времени.Однако мы мало знаем о
долгосрочные эффекты этих компенсаторных механизмов. Последствия для
здоровье человека становится более очевидным, поскольку мы больше понимаем природу
компенсации в нейронах и как это может быть связано с травмами и болезнями
процессы в нервной системе.
Рис. 3.
Переменная проводимость мембраны и экспрессия ионных каналов в одном латеральном
pyloric (LP) нейроны стоматогастрального ганглия краба. (A) Два нейрона LP
от двух разных животных демонстрируют устойчивое сохранение продукции.(В)
Двухэлектродные клещи для измерения напряжения трех проводимостей K +
( I Kd = выпрямитель с задержкой,
I K [Ca] = кальций-активированный K + ,
I A = быстродействующий A-тип) в нейронах LP из девяти
различных животных показывает, что нейроны с функционально схожими выходами показывают
очень разные уровни проводимости мембран. (C) Количественные измерения ПЦР
выражения трех каналов K + , несущих проводимость
измеренные на рис.3B ( shab [ I Kd ], BK-KCa
[ I K [Ca] ], шлифовальный [ I A ]) в
те же ЛП нейроны. Такой же уровень изменчивости существует на уровне генов.
экспрессия и проводимость мембраны. Эти данные в сочетании с корреляциями
между измеренной проводимостью мембраны и экспрессией ионных каналов в нейронах LP
краба (D) демонстрируют, что эта изменчивость имеет биологическое значение
и не является результатом «шума» в записях фиксаторов напряжения или
количественный анализ экспрессии генов.Эти данные позволяют предположить, что эти
нейроны постоянно корректируют свои внутренние свойства с через
зависящие от деятельности процессы для поддержания согласованного функционального
вывод. Рисунок адаптирован из Schulz et al.
(Schulz et al., 2006) и
воспроизводится с разрешения. Записи любезно предоставлены Ж.-М. Goaillard.
Восстановление и изменение функции нейронной сети после
травма
Помимо компенсаторных механизмов в ответ на изменение нормального
активность нейронов, долговременные изменения возбудимости нейронов были
демонстрируется как реакция на деафферентацию или повреждение входных путей к
нейронные цепи.Предположительно эти изменения действуют как компенсаторный механизм для
попытка восстановить нервную функцию после травмы. В некоторых случаях функциональный
вывод может быть получен частично или полностью после некоторой формы
компенсаторные процессы в этих нейронных сетях, чтобы приспособить их
радикально изменены нисходящие входы.
Один из самых ярких примеров восстановления нервной функции после
деафферентация происходит в вестибулярной системе. Управление вестибулярной системы
чувство движения и равновесия, и имеет фундаментальное значение в
функционирующая нервная система.У млекопитающих волокна вестибулярного нерва
постоянно разряжать, даже при отсутствии движения, что приводит к
непрерывная активность во всех нейронах вестибулярных ядер. Это спонтанное
активность прекращается после лабиринтэктомии (удаления внутреннего уха), что вызывает
аномальные вестибулярные рефлексы и стойкие симптомы нистагма (быстрые,
непроизвольные движения глаз) и аномалии позы, такие как наклон головы.
Тем не менее, примечательно, что этот синдром постепенно проходит со временем в процессе, известном как
«вестибулярная компенсация», приводящая к уменьшению нарушений осанки и
нистагм, оставляющий только аномалии более высокого порядка в динамических вестибулярных
рефлексы и когнитивные функции, связанные с потерей вестибулярной информации
(Дарлингтон и др., 2002).
Приходит второй пример восстановления функции после деафферентации.
из стоматогастрального ганглия ракообразных (СТГ). Модулирующие входы в
STG контролирует выходные шаблоны, которые он производит. Если все модулирующие входы
ганглий удаляется, его ритмический выход либо полностью прекращается, либо
резко уменьшается по частоте. Хотя пилорический ритм скоро утихнет
после того, как модуляторные входы удалены, ритм самопроизвольно восстанавливается в
отсутствие модуляторов через 2-5 дней после деафферентации
(Golowasch et al., 1999;
Тоби-Бриссон и Симмерс,
1998). Эти результаты предполагают, что при отсутствии входных данных
которые производят постоянную активность в STG, эти нейроны и сети «перенастраиваются»
сами так, чтобы они могли производить практически нормальный результат.
Оба этих примера предполагают существование долгосрочного механизма
стабильность и гомеостаз под влиянием активности нисходящих
прогнозы. Но как этого добиться? И в STG, и в вестибулярном
системы, ответ, по-видимому, частично связан с изменениями в
собственная возбудимость нейронов, участвующих в генерации спонтанных
деятельность этих сетей.Во время вестибулярной компенсации у морской свинки
в глухих нейронах медиального вестибулярного ядра наблюдаются изменения в
собственная возбудимость, которая может лежать в основе механизма восстановления покоя
активность в этих нейронах (рассмотрено
Darlington et al., 2002):
эти клетки имеют более деполяризованный потенциал покоя, изменения входных
сопротивление, увеличение потенциалов плато и изменение спайков и
частотный отклик. Далее, увеличивается распространенность низкого порога
кальциевые токи (которые способствуют активности водителя ритма в этих клетках)
был продемонстрирован на лабиринтэктомированных животных
(Рис и др., 2003). в
СТГ, восстановление ритмической активности коррелирует с изменениями мембраны
проводимость, соответствующая увеличению возбудимости кардиостимулятора
нейроны, клетки PD. Ячейки PD показывают пониженную проводимость K + и
повышенный уровень гиперполяризации активировал входящий ток
[ I H ] (Тоби-Бриссон
и Симмерс, 2002).
Вместе эти две системы и изменения, приводящие к внутреннему
свойства составляющих их нейронов предполагают, что восстановление функции
последующая деафферентация, по крайней мере, частично является результатом перенастройки
собственная возбудимость.Следует отметить, что вестибулярная компенсация и
восстановление ритма в STG имеет одну поразительную черту: они оба
возникают в клетках, нормальный образец вывода которых спонтанный и непрерывный
стрельба. Один из ключевых вопросов на будущее — это восстановление функции
парадигмы также встречаются в клетках, которые не обладают постоянной активностью.
Будущие вопросы
В этом обзоре основное внимание уделяется способности нейронов изменять свои внутренние
возбудимость в результате деятельностных процессов.Эти изменения
принимают форму как пластичности, так и поддержания нейронального выхода. Такие
явления имеют широкое значение для нервной системы, как с точки зрения нашего
понимание нормальной нервной функции, а также реакции на травмы и
болезнь. В следующих абзацах я выделяю три общих вопроса, стоящих перед
будущие исследования в этой области.
Каким образом клетка достигает баланса между пластичностью возбудимости
и стабилизирующая компенсация?
Способность ячеек изменять свой вывод в ответ на изменение
условия окружающей среды или изменение пресинаптического входа лежит в основе многих
функций нервной системы, включая, конечно, обучение и память.Еще
неконтролируемая пластичность может привести к модуляции клеток до такой степени, что они
больше не способны выдавать значимый результат. Следовательно
взаимодействие между этими двумя процессами имеет решающее значение: слишком большая пластичность может
привести к хаосу, слишком мало ограничивает способность животного к обучению и адаптации.
Понимание этого уравновешивающего действия позволит нам глубже понять
общая работа нейронов и нейронных цепей, к которым они принадлежат.
Каковы механизмы изменения собственной возбудимости и
в каких временных масштабах они действуют?
Чтобы быть эффективной, пластичность должна проявляться в разных временных масштабах.Долгосрочное
память требует изменений в выводе ячеек, которые длятся дни, недели или даже
лет. Многие из этих событий требуют взаимодействия с геномом и
долговременные изменения синтеза белка. Тем не менее, краткосрочная адаптация происходит
постоянно в ответ на изменение условий окружающей среды и должны действовать
по путям быстрее, чем транскрипция и трансляция гена.
Хотя в настоящее время мало что известно о механизмах, управляющих сдвигами в
внутренняя возбудимость, будущая работа позволит нам определить прямую
механизмы такой пластичности, а также дают представление о том, как краткосрочные
изменения фильтруются и распределяются по приоритетам на те, которые станут долгосрочными
изменения.
Какое значение имеет эта пластичность для здоровья человека?
Наконец, с новым пониманием пластичности на уровне
возбудимость нейронов, мы можем получить более полное представление о причинах и
лечение неврологических заболеваний человека. Например, недавние исследования показывают
что некоторые эпилепсии можно частично объяснить «беглым» гомеостатическим
процессы, вызванные повреждением афферентных путей
(Houweling et al., 2005).
Кроме того, зная, что свойства нейронов изменяются деафферентацией, что
каковы последствия этих потенциальных изменений при травме спинного мозга?
Будет ли восстановлено соединение спинных сетей, которые больше не будут «понимать» высший порядок
команды, которые они получают из-за обширных изменений в нейронных и сетевых
свойства? Более полное понимание этих процессов поможет избавиться от
осветить некоторые из самых изнурительных неврологических проблем, с которыми сталкивается человек
здоровье.
БЛАГОДАРНОСТИ
Я хотел бы поблагодарить Л. К. Шульца и М. Гарсиа за чтение предыдущего
версии этой рукописи. Инжир.
2 адаптировано из Aizenman et al.
(Aizenman et al., 2003) с
разрешение Elsevier. Рис. 3
перепечатано из Schulz et al. (Шульц и др.
др., 2006) с разрешения авторов.
- © Компания Биологов Лимитед
2006
Список литературы
- ↵
Айзенман, К.Д. и Линден Д. Дж. (2000).
Быстрое, синаптически управляемое увеличение собственной возбудимости
нейроны глубокого ядра мозжечка. Nat. Neurosci.
3, 109-111. - ↵
Айзенман, К. Д., Муньос-Элиас, Г. и Клайн, Х. Т.
(2002). Визуально управляемая модуляция глутаматергического синаптического
передача опосредуется регуляцией внутриклеточных полиаминов.
Нейрон 34 623
-634. - ↵
Айзенман, К.Д., Акерман, К. Дж., Йенсен, К. Р. и Клайн, Х.
Т. (2003). Визуально управляемая регуляция внутренних нейронов
возбудимость улучшает обнаружение стимула in vivo.
Нейрон 39 831
-842. - ↵
Алкон Д. Л. (1984). Опосредованное кальцием снижение
ионных токов: след биофизической памяти. Наука
226 1037
-1045. - ↵
Антонов И., Антонова И., Кандел Э. Р. и Хокинс Р. Д.
(2001). Вклад зависимых от активности синаптических
пластичность к классическому кондиционированию в Aplysia. Дж.
Neurosci. 21,6413
-6422. - ↵
Аптович, К. О., Кунклер, П. Э. и Крейг, Р. П.
(2004). Гомеостатическая пластичность в культурах срезов гиппокампа
включает изменения в экспрессии потенциалзависимых каналов Na +. Мозг
Res. 998 155
-163. - ↵
Армано, С., Росси, П., Тальетти, В.и Д’Анджело, E.
(2000). Долгосрочное усиление собственной возбудимости
синапс из мшистых волокон-гранул мозжечка крысы. Дж.
Neurosci. 20 5208
-5216. - ↵
Брикли, С. Г., Ревилла, В., Калл-Кэнди, С. Г., Висден, В. и
Фаррант М. (2001). Адаптивная регуляция нейронов
возбудимость за счет независимой от напряжения калиевой проводимости.
Природа 409,88
-92. - ↵
Кадмор, Р.H. и Turrigiano, G.G. (2004).
Долгосрочное усиление собственной возбудимости зрительного кортикального слоя ЛЖ.
нейроны. J. Neurophysiol.
92 341
-348. - ↵
Даудал, Г. и Дебанн, Д. (2003). Долгосрочное
пластичность собственной возбудимости: правила и механизмы обучения.
Учить. Mem. 10 456
-465. - ↵
Дарлингтон, К. Л., Дутиа, М. Б. и Смит, П. Ф.
(2002). Вклад собственной возбудимости
нейроны вестибулярного ядра для восстановления после вестибулярного повреждения.Евро.
J. Neurosci. 15,1719
-1727. - ↵
Дэвис Г. В. и Безпрозванный И. (2001).
Поддержание стабильности нервной функции: гомеостатическая гипотеза.
Анну. Rev. Physiol. 63 847
-869. - ↵
Этеридж, Дж. А., Мерчисон, Д., Эбботт, Л. К. и Гриффит, В.
H. (2005). Функциональная компенсация другим напряжением
Са (2+) каналы в нейронах базального переднего мозга мышей с Са (V) 2.1 мутации.
Brain Res. DOI: 10.1016 / j.brainres.2005.11.007
. - ↵
Фрик А., Маги Дж. И Джонстон Д. (2004).
ДП сопровождается повышенной локальной возбудимостью пирамидного нейрона.
дендриты. Nat. Neurosci.
7, 126-135. - ↵
Гайнутдинов К. Л., Чекмарев Л. Дж., Гайнутдинова Т. Х.
(1998). Повышение возбудимости интернейронов отмены после
кондиционирование в улитке.NeuroReport
9, 517-520. - ↵
Golowasch, J., Casey, M., Abbott, L. F. и Marder, E.
(1999). Стабильность сети от зависимого от активности регулирования
нейронные проводимости. Neural Comput.
11 1079
-1096. - ↵
Golowasch, J., Goldman, M. S., Abbott, L. F. и Marder, E.
(2002). Невозможность усреднения при построении
модель нейрона на основе проводимости. J. Neurophysiol.87,1129
-1131. - ↵
Houweling, A. R., Bazhenov, M., Timofeev, I., Steriade, M. и
Сейновски, Т. Дж. (2005). Гомеостатическая синаптическая пластичность может
объяснить посттравматический эпилептогенез в хронически изолированном неокортексе.
Цереб. Кора 15 834
-845. - ↵
Ли, К. Ю., Лу, Дж. Т., Ву, К. П., Дуан, С. М. и Пу, М. М.
(2004). Двунаправленная модификация пресинаптических нейронов
возбудимость, сопровождающая спайк-зависимую синаптическую пластичность.Нейрон 41257
-268. - ↵
Лю, З., Головаш, Дж., Мардер, Э. и Эбботт, Л. Ф.
(1998). Модельный нейрон с проводимостью, зависящей от активности
регулируется несколькими датчиками кальция. J. Neurosci.
18,2309
-2320. - ↵
Маклин, Дж. Н., Чжан, Ю., Джонсон, Б. Р. и Харрис-Уоррик, Р.
М. (2003). Независимый от активности гомеостаз в ритмичном
активные нейроны. Нейрон
37 109
-120. - ↵
Маклин, Дж. Н., Чжан, Ю., Гериц, М. Л., Кейси, Р., Олива, Р.,
Гукенхаймер, Дж. И Харрис-Уоррик, Р. М. (2005).
Независимая от активности корегуляция IA и Ih в ритмически активных нейронах.
J. Neurophysiol. 94,3601
-3617. - ↵
Ми, К. Дж., Пим, Э. К., Моффат, К. Г. и Бейнс, Р. А.
(2004). Регулирование возбудимости нейронов посредством
пумилиозависимый контроль гена натриевого канала.Дж.
Neurosci. 24,8695
-8703. - ↵
Муди, У. Дж. И Босма, М. М. (2005). Ион
развитие каналов, спонтанная активность и развитие в зависимости от активности
в нервных и мышечных клетках. Physiol. Ред.
85 883
-941. - ↵
Мойер, Дж. Р., младший, Томпсон, Л. Т. и Дистерхофт, Дж. Ф.
(1996). Прослеживание кондиционирования моргания увеличивает возбудимость CA1 в
временный и ориентированный на обучение способ.J. Neurosci.
16,5536
-5546. - ↵
Петерсен, С. А., Феттер, Р. Д., Ноордермейр, Дж. Н., Гудман, К.
С. и ДиАнтонио А. (1997). Генетический анализ глутамата
рецепторов у Drosophila обнаруживает ретроградный сигнал, регулирующий пресинаптические
выпуск передатчика. Нейрон
19 1237
-1248. - ↵
Prinz, A. A., Billimoria, C. P. and Marder, E.
(2003). Альтернатива ручной настройке моделей на основе проводимости:
построение и анализ баз данных модельных нейронов.Дж.
Neurophysiol. 90,3998
-4015. - ↵
Prinz, A. A., Bucher, D. and Marder, E. (2004).
Подобная сетевая активность из-за разнородных параметров цепи. Nat.
Neurosci. 7,1345
-1352. - ↵
Рис, Л., Капрон, Б., Неклерк, Д., Александр, Х., Синдик, К.,
Toubeau, G. и Godaux, E. (2003). Изменения лабиринтэктомии
Кальциевые каналы Т-типа в вестибулярных нейронах морской свинки.Нейроотчет 14,1585
-1589. - ↵
Санчес-Андрес, Дж. В. и Алкон, Д. Л. (1991).
Анализ фиксации напряжения влияния классического кондиционирования на
гиппокамп. J. Neurophysiol.
65 796
-807. - ↵
Сандрок, А. В., младший, Драйер, С. Э., Розен, К. М., Гозани, С. Н.,
Крамер Р., Тейл Л. Э. и Фишбах Г. Д. (1997).
Поддержание числа рецепторов ацетилхолина нейрегулинами на
нервно-мышечное соединение in vivo.Наука
276 599
-603. - ↵
Schulz, D. J., Goaillard, J. M. и Marder, E.
(2006). Переменное выражение канала в идентифицированных одиночных и
электрически связанные нейроны у разных животных. Nat.
Neurosci. 9 356
-362. - ↵
Тоби-Бриссон, М. и Симмерс, Дж. (1998).
Нейромодуляторные входы поддерживают экспрессию моторики омара
сеть, генерирующая паттерн, в состоянии, зависящем от модуляции: данные
долгосрочная децентрализация in vitro.J. Neurosci.
18,2212
-2225. - ↵
Тоби-Бриссон, М. и Симмерс, Дж. (2002).
Долгосрочная нейромодуляторная регуляция сети, генерирующей двигательные паттерны:
поддержание синаптической эффективности и осцилляторных свойств. Дж.
Neurophysiol. 88,2942
-2953. - ↵
Томпсон, Л. Т., Мойер, Дж. Р., мл. И Дистерхофт, Дж. Ф.
(1996). Преходящие изменения возбудимости нейронов CA3 кролика
с курсом времени, подходящим для поддержки консолидации памяти.Дж.
Neurophysiol. 76,1836
-1849. - ↵
Turrigiano, G.G. (1999). Гомеостатический
пластичность нейронных сетей: чем больше что-то меняется, тем дольше остается
тоже самое. Trends Neurosci.
22 221
-227. - ↵
Turrigiano, G. G. и Nelson, S. B. (2004).
Гомеостатическая пластичность в развивающейся нервной системе. Nat. Ред.
Neurosci. 5,97
-107. - ↵
ван Велие, И., van Hooft, J. A. and Wadman, W. J.
(2004). Гомеостатическое масштабирование возбудимости нейронов синаптическим
модуляция каналов Ih, активируемых соматической гиперполяризацией.
Proc. Natl. Акад. Sci. Соединенные Штаты Америки
101 5123
-5128. - ↵
Сюй, Дж., Кан, Н., Цзян, Л., Недергаард, М. и Кан, Дж.
(2005). Зависимое от активности долгосрочное усиление внутреннего
возбудимость в пирамидных нейронах СА1 гиппокампа. Дж.
Neurosci. 25,1750
-1760. - ↵
Чжан, В.и Linden, D. J. (2003). Другой
сторона инграммы: обусловленные опытом изменения во внутреннем
возбудимость. Nat. Rev. Neurosci.
4, 885-900. - ↵
Zhang, Y., Oliva, R., Gisselmann, G., Hatt, H., Guckenheimer, J.
и Харрис-Уоррик, Р. М. (2003). Сверхэкспрессия
ген канала катионного тока, активируемого гиперполяризацией (Ih), изменяет
активация идентифицированных мотонейронов в небольшой нейронной сети.
J. Neurosci.23 9059
-9067.
Клеточно-специфическая регуляция внутренней возбудимости нейронов с помощью макроаутофагии
Резюме:
Авторы представляют обширную работу, которая в целом является убедительной и исчерпывающей, фокусируясь на мышах, которые сочетают Drd1-Cre и Adora2A-Cre с Atg7-fl / fl. У отчета много сильных сторон — аутофагия как в dPSN, так и в iPSN с электрофизиологическим анализом; описание нового субстрата аутофагии Kir2 и потенциальной молекулярной основы его деградации и ингибирования; и клеточная деградация Kir2 в головном мозге, и т. д.Это солидная работа лаборатории, опубликовавшей множество интересных отчетов о роли аутофагии в функции нейронов.
Мы благодарим рецензентов за их энтузиазм по поводу этой рукописи. Как подробно описано ниже, мы отредактировали и реорганизовали рукопись для повышения ясности. Кроме того, чтобы учесть опасения и предложения рецензентов, мы добавили в рукопись несколько новых наборов данных, включая: (1) электрофизиологические записи из 60 клеток, полученных от 13 дополнительных мышей (включая несколько следующих после стереотаксической хирургии), (2) данные вестерн-блоттинга из 28 дополнительных мышей (14 контрольных, 7 dSPN Atg7cKO и 7 iSPN Atg7cKO мышей), (3) поведенческие данные из новой когорты из 36 животных, включая ротарод и груминг, как предложено авторами обзора, и (4) клетка культурные эксперименты, направленные на объяснение механизма, посредством которого ацетилирование влияет на активность канала Kir2.Мы считаем, что эти дополнительные данные существенно укрепляют выводы, сделанные в этой рукописи, и надеемся, что рецензенты согласятся, что теперь она пригодна для публикации в eLife .
Существенные изменения:
1) Все рецензенты считали, что рукопись все еще находится в черновом формате, с критическими ошибками в перекрестных ссылках на цифры, а также неоптимальной организацией для eLife. Как описано в приведенном ниже сборнике моментов, рукопись не готова к публикации и ее было излишне трудно читать.Необходимо тщательное переписывание и повторное редактирование.
Мы благодарим рецензентов за указание на общую необходимость повышения удобочитаемости исследования. Мы тщательно отредактировали рукопись, чтобы улучшить ее состав и организацию. Это повлекло за собой изменение нумерации рисунков и таблиц, и для облегчения сравнения версий в этой таблице перечислены различия в рисунках и таблицах между пересмотренными и исходными материалами.
| Пересмотренное представление | Исходное представление | Дополнительные данные в ревизии | |||
| Рисунок 1 | Рисунок S1 | ||||
| Рисунок 2 | Рисунок 1 | ||||
| Рисунок 4 | Рисунок 3 | ||||
| Рисунок 4 — дополнение к рисунку 1 | Рисунок S3 | ||||
| Рисунок 5 | Рисунок 4 | Вестерн-блот-анализ от 14 новых мышей (p62) | Рисунок 5 — дополнение к рисунку 1 | Рисунок S5 | Вестерн-блот-анализ от 28 дополнительных мышей |
| Рисунок 5 — приложение к рисунку 2 | Рисунок S6 | ||||
| Рисунок 5 — приложение к рисунку 3 | Рисунок S6 | ||||
| Рисунок 6 | Рисунок S4 | Записи с 10 дополнительных мышей после стереотаксических вирусных инъекций | |||
| Рисунок 7 | Рисунок 5 | ||||
| Рисунок 7 — дополнение к рисунку 1 | Рисунок S8 | ||||
| Рисунок 8 | Рисунок 6 | Не в исходной заявке | Дополнительные данные о культуре клеток, демонстрирующие, что Kir2.1 K334R менее ацетилирован, чем канал WT, и исследование поверхностных уровней мутантов Kir2.1 K334R и K334Q | ||
| Удалено из исправленной рукописи | Рисунок S2 | Как предложено рецензентами | |||
| Таблица 1 | Дополнительные данные были включены для мышей каждого пола, как подробно описано ниже. | ||||
| Таблица 2 | Таблица S2 | Статистическая информация для всех рисунков была включена в текст подписей к рисункам, за исключением рисунка 3, который остается в таблице 2. | |||
| Таблица 3 | Таблица S3 | ||||
| Таблица S1 | Таблица S4 | ||||
| Таблица S2 | Таблица S5 | ||||
9050 Таблица S3 9050
Мы благодарим рецензентов за эти комментарии и считаем, что дополнительные данные в отредактированной рукописи подкрепляют ее выводы.Теперь мы включили 7 дополнительных мышей в анализ клеточной специфичности Cre-опосредованной рекомбинации на рисунке 1; 36 мышей обоего пола в поведенческом анализе на Фигуре 2; 13 мышей в электрофизиологических экспериментах на рисунках 3 и 6; и 28 мышей в биохимических экспериментах на Рисунке 5 и Рисунке 5 — приложение к рисунку 1. Обратите внимание, что для многих выводов в этой рукописи мы представляем данные из нескольких ортогональных подходов (например, комбинирования биохимии in vivo с гетерологичными системами), которые обеспечивают согласованные результаты.Мы надеемся, что независимые подходы, в дополнение к новым данным, улучшат оценку строгости рецензентами. Мы значительно переписали раздел «Обсуждение», чтобы обеспечить более сбалансированный взгляд на наши выводы. Что касается включения пола в качестве переменной в рукопись, мы теперь включаем дополнительных мышей-самцов и самок всех генотипов в поведенческий анализ, показанный на Рисунке 2. Мы выполнили двухфакторный дисперсионный анализ ANOVA для каждой поведенческой задачи с полом и генотипом в качестве факторов, и не обнаружили значимого взаимодействия между полом и генотипом ни в одной поведенческой задаче (см. Таблицу 1).Таким образом, мы пришли к выводу, что пол не влияет существенно на эффект генотипа в этих экспериментах, и используем объединенные данные для обоих полов на последующих рисунках. Более того, поскольку мы изначально не планировали эти эксперименты для выявления половых различий, у нас нет достаточных возможностей делать заявления о любых половых различиях в электрофизиологических и биохимических экспериментах. Мы добавили заявление в разделе результатов, поясняющее это: «Обратите внимание, что в этом анализе мы объединили данные обоих полов.Мы не планировали эти эксперименты для выявления половых различий, так как в поведенческом анализе не было взаимодействия между полом и генотипом ».
Мы выражаем признательность рецензентам за их активное участие в работе над нашей рукописью и ценим подробные предложения.которые, как нам кажется, значительно улучшили рукопись. Наши отзывы и изменения к рукописи подробно описаны ниже.
Приносим извинения за неправильную ссылку на эту цифру в исходном сообщении. Теперь мы включаем этот рисунок в качестве основного (рисунок 6 в измененной рукописи), как было предложено рецензентами. Кроме того, мы расширили описание этого эксперимента в разделе «Результаты» и добавили раздел об этом рисунке в разделе «Обсуждение»: Из раздела результатов: «Хотя ранее было показано, что аутофагия регулирует интегральные белки плазматической мембраны, контролируя трафик мембранных белков, взаимодействие с партнерами или деградацию (Gao et al., 2018; Rowland et al., 2006; Shehata et al., 2012; Sumitomo et al. al., 2018; Yan et al., 2018), неожиданная обратная зависимость между общим белком Kir2 и током Kir2 в iSPN, лишенных Atg7, требует дальнейшей проверки.[…] Эти результаты демонстрируют, что снижение тока Kir2 у мышей iSPN Atg7cKO может дополняться повторной экспрессией Atg7, но не сверхэкспрессией Kir2.1, во взрослом возрасте ». Из раздела Обсуждение: «Мы также использовали стратегию вирусной сверхэкспрессии, чтобы подтвердить, что снижение активности Kir2 в iSPN, лишенных Atg7, не является результатом снижения экспрессии мРНК Kir2. Вирусная сверхэкспрессия Kir2.1 не может увеличивать токи Kir2 в iSPNs, лишенных Atg7, демонстрируя, что Atg7 необходим для того, чтобы вновь синтезированные каналы стали функциональными.[…] Мы предполагаем, что недавно синтезированный Kir2.1 в iSPN, лишенных Atg7, в этих экспериментах ацетилирован и не подвергается аутофагической деградации, предотвращая функциональное увеличение тока Kir2.1 ».
Мы согласны с этим и переместили его на основной рисунок 1 в измененной рукописи. Мы также теперь упоминаем, что «флоксированные» мыши Atg7, трансгенные мыши D1cre и A2Acre ранее были валидированы и широко использовались в литературе (например, (Durieux et al., 2012; Hernandez et al., 2012; Komatsu et al. ., 2006, 2005, Козоровицкий и др., 2015, 2012; Tang et al., 2014)).
Теперь мы включили дополнения к рисункам в соответствии с текстом в измененную рукопись, как это будет выглядеть в опубликованном формате eLife , чтобы уменьшить необходимость переключения между основным текстом и приложением. Мы включили Рисунок S1 и Рисунок S4 из исходной заявки, как Рисунок 1 и Рисунок 6, соответственно, пересмотренной заявки (см. Ответ на пункт 5 ниже). Реферат переписан следующим образом: «Базальные ганглии — это группа подкорковых ядер, которые способствуют отбору действий и обучению с подкреплением, оценивая сенсомоторные и поощрительные входы и контролируя таламокортикальную активность и моторную отдачу.Основные нейроны полосатого тела, ГАМКергические проекционные нейроны шипиков прямого (dSPN) и непрямого (iSPN) путей, поддерживают низкую внутреннюю возбудимость и требуют конвергентных возбуждающих входов для возбуждения и, таким образом, фильтрации информации перед ее передачей в выходные ядра базальных ганглиев. Какие клеточные механизмы обеспечивают правильные синаптические и внутренние свойства SPN? Недавние открытия показывают, что макроаутофагия регулирует синаптическую активность в возбуждающих нейронах, нервно-мышечном соединении Drosophila и нейронах нематод.Здесь мы исследовали роль аутофагии в физиологии SPN и поведении животных путем создания условных нокаутов Atg7 в dSPN или iSPN. Потеря аутофагии в любой популяции SPN приводила к изменениям в моторном обучении, но отчетливо влияла на клеточную физиологию. dSPN, но не iSPN, требовали аутофагии для нормальной дендритной структуры и синаптического входа. Напротив, iSPN, но не dSPN, по своей природе были сверхвозбудимыми. Собственная гипервозбудимость iSPN возникает из-за снижения функции внутреннего выпрямляющего калиевого канала Kir2.В отсутствие аутофагии общий и поверхностный уровни белка Kir2 были повышены, но активность Kir2 ингибировалась ацетилированием. Эти данные определяют новый механизм, с помощью которого аутофагия регулирует активность нейронов: контроль собственной возбудимости через регулирование функции калиевых каналов ».
Возможно, самые поразительные и удивительные результаты нашего исследования — это разные последствия, которые потеря аутофагии оказывает на dSPN и iSPN. Хотя возможным объяснением может быть различие в возрасте, в котором происходит экспрессия Cre между линиями драйверов D1cre и A2Acre, обе делеции происходят задолго до изменений возбудимости. В деталях, обе линии Cre-драйвера, использованные в этом исследовании (D1cre ey262 и A2Acre KG139), демонстрируют широко распространенную экспрессию в соответствующем типе клеток к 7-му постнатальному дню (Kozorovitskiy et al., 2015, 2012), что происходит до созревания собственной возбудимости SPN и до основного периода стриарного синаптогенеза (Lieberman et al., 2018; Peixoto et al., 2016; Tepper et al., 1998). Кроме того, мы подтвердили, что аналогичное количество клеток p62 + присутствует у мышей dSPN Atg7cKO и iSPN Atg7cKO на P28, возрасте, в котором проводились электрофизиологические записи на рисунках 3 и 4 (изображение ответа автора 1). Более того, аналогичные фракции dSPN и iSPN обнаруживают включения p62 в соответствующих условных нокаутах в зрелом возрасте (Рис. 1). Аналогичное количество клеток p62 + в полосатом теле dSPNAtg7cKO и iSPN Atg7cKO на P28. Данные были проанализированы с помощью однофакторного дисперсионного анализа с последующим апостериорным тестом Бонферрони. Также обратите внимание, что подход, который мы использовали для сравнения эффекта потери определенного белка в dSPN или iSPN (используйте линии Credriver), ранее описывался в литературе с теми же конкретными линиями драйверов Cre (Daigle et al., 2014; Hutton et al., 2017; Koranda et al., 2018; Козоровицкий и др., 2012; Ламбот и др., 2016; Rothwell et al., 2014; Tan et al., 2013; Urs et al., 2016, 2012). Это свидетельство позволяет нам предположить, что разница во времени экспрессии Cre не влияет на отдельные фенотипы, наблюдаемые между линиями с условным нокаутом в этом исследовании, и подчеркивает валидность этого подхода при анализе специфических эффектов потери аутофагии на dSPN и iSPN. Мы думаем, что данные подтверждают важное значение этого исследования: аутофагия может потребоваться в разных типах клеток в разных окнах развития. При дальнейшем сравнении линий cre в линии драйвера ey262 D1cre корковая рекомбинация происходит, как описано ранее (Kozorovitskiy et al., 2012), но отсутствует в линии A2Acre (данные не показаны). Утрата аутофагии в некоторых популяциях кортикальных нейронов может способствовать синаптическим изменениям в dSPN, и в настоящее время мы не можем исключить эту возможность; однако мы попытались решить эту проблему двумя способами. Во-первых, если синаптические дефициты возникают исключительно из-за пресинаптической потери Atg7, мы могли бы ожидать, что частота mEPSC будет отличаться у мышей iSPN от dSPN Atg7cKO мышей, потому что dSPN и iSPN разделяют большинство корковых входов (Guo et al., 2015). Частота и амплитуда mEPSC не отличались в iSPN от dSPN Atg7cKO по сравнению с dSPN Atg7ctrl мышей (изображение ответа автора 2). Мы решили не включать эти данные в пересмотренную заявку, потому что у нас нет соответствующих данных в dSPN от мышей iSPN Atg7cKO , но мы будем рады обсудить это, если рецензенты сочтут нужным. Нет изменений в частоте или амплитуде mEPSC в iSPN по сравнению с мышами dSPNAtg7cKO . mEPSC регистрировали из iSPN у мышей dSPN Atg7cKO и сравнивали с контрольными iSPN. Мы показываем здесь, что iSPN от мышей dSPN Atg7cKO имеют эквивалентную ( A ) частоту mEPSC и ( B ) амплитуду mEPSC, как iSPN от контрольных мышей. Данные от dSPN, происходящие от контрольных мышей или мышей dSPN Atg7cKO , воспроизводятся здесь для справки с Рисунка 3. Контрольные данные iSPN, также воспроизведенные с Рисунка 3.Данные анализируют с помощью двухфакторного дисперсионного анализа с последующим тестом Бонферрони posthoc. ( A ) Подтип x Генотип: F (1,75) = 11,57, p = 0,0011. ( B ) Подтип x Генотип: F (1,77) = 4,444, p = 0,0383. iSPN от мышей dSPN Atg7cKO : n = 11,3. N для другой группы такие же, как на рисунке 3. Во-вторых, отметим, что парная частота импульсов вызванных возбуждающих постсинаптических токов (eEPSC), классический тест вероятности пресинаптического высвобождения, в dSPN из dSPN Atg7cKO не отличалась от таковой для dSPN из dSPN Atg7Ctrl мышей ( Изображение ответа автора 3).Это говорит о том, что во время нашей записи нет никакой разницы в парном соотношении импульсов возбуждающих входов на dSPN (и, следовательно, нет явного изменения в вероятности высвобождения) и, следовательно, изменение частоты mEPSC в dSPNS от dSPN Atg7cKO мышей не возникает из-за продолжающейся дисфункции пресинаптических входов. В соответствии с предложениями рецензентов ниже (см. Ответ на этот вопрос) мы не включили эти данные в пересмотренную заявку. Мы добавили предложение в раздел «Результаты», в котором упоминается, что равное количество клеток p62 + присутствует в полосатом теле на P28.Мы также включили дополнительный абзац в раздел «Обсуждение» пересмотренной заявки, в котором рассматривается возможность того, что различия между линиями драйверов Cre могут лежать в основе специфических для клеточного типа эффектов потери аутофагии в полосатом теле. Раздел результатов: «Наконец, мы подтвердили, что подобное количество клеток p62 + присутствует в полосатом теле мышей dSPNAtg7cKO и iSPNAtg7cKO на P28, когда были собраны электрофизиологические записи на рисунках 3 и 4 (данные не показаны).” Раздел обсуждения: «Возможно, наиболее удивительным является тот факт, что iSPN, в которых отсутствует Atg7, не показывают изменений в сложности дендритов, плотности шипов или возбуждающих сигналов. […] Дальнейшие усилия по определению основных механизмов, которые вносят вклад в специфические для клеточного типа роли в аутофагии в полосатом теле, могут включать линии Credriver, в которых нацелены как dSPN, так и iSPN, чтобы исключить вклад различных временных курсов экспрессии между используемыми линиями Cre в этом исследовании.» Отсутствие изменений в соотношении парных импульсов (PPR) возбуждающих входов к dSPN от мышей dSPNAtg7cKO . ( A ) Репрезентативные следы вызванных EPSC в dSPN от контрольных мышей или мышей dSPN Atg7cKO . EPSC были вызваны в присутствии 25 мкМ пикротоксина после электростимуляции в полосатом теле на расстоянии> 100 мкм от тела клетки. ( B ) Отсутствие влияния потери аутофагии dSPN на парную частоту импульсов вызванных EPSC. Контроль: n = 7,2; dSPN Atg7cKO : n = 11,3. Задержка EPSC составляет 5-10 мс во всех исследованных ячейках.
Мы благодарим рецензентов за то, что они подтолкнули нас к расширению нашей дискуссии о том, почему iSPN не демонстрируют морфологические изменения, которые мы и другие видели в других популяциях нейронов после потери аутофагии.Это особенно интересный вопрос, учитывая, что в dSPN есть эти изменения. К сожалению, мало что известно о том, как аутофагия может контролировать морфологию нейронов (O.J. Lieberman et al., 2019; Nikoletopoulou and Tavernarakis, 2018). Возможные варианты включают изменения в функции митохондрий, ответ на нейротрофические факторы и дифференциальный ответ цитоскелета на нейромодуляторную передачу сигналов. Дальнейшие усилия будут сосредоточены на сравнении влияния потери аутофагии на эти молекулярные пути в dSPN и iSPN.Эти возможности рассматриваются в дополнительных параграфах в новом разделе «Обсуждение»: «Возбуждающий синаптогенез на iSPNs может происходить независимо от аутофагии. Как только механизм, посредством которого аутофагия регулирует сложность дендритов и синаптогенез в dSPN, будет идентифицирован, будущие исследования смогут сравнить этот процесс с iSPN и определить, почему потеря аутофагии в iSPN не влияет на синаптогенез iSPN ». и «Аутофагия необходима для нормальной синаптической структуры и функции в C.elegans , нервно-мышечного соединения Drosophila и возбуждающих нейронов коры головного мозга и гиппокампа мышей (Glatigny et al., 2019; Nikoletopoulou et al., 2017; Shehata et al., 2012; Shen and Ganetzky, 2009; Stavoe et al. ., 2016; Tang et al., 2014; Vanhauwaert et al., 2017; Yan et al., 2018). […] Мы предполагаем, что, учитывая динамические изменения аутофагического потока, которые происходят в SPN во время раннего постнатального развития (P10-P18; (O. Lieberman et al., 2019)), аутофагия может играть роль в росте дендритов и возбуждающем синаптогенезе. на dSPN.”
Как предполагают составители обзора, Atg7, хотя изначально идентифицирован как необходимый ген для макроаутофагии, играет роли в др. Клеточных процессах, таких как LC3-ассоциированный фагоцитоз и секреция лизосомного содержимого (Subramani and Malhotra, 2013). Обратите внимание, что хотя мы исследовали только мышей с условным нокаутом Atg7, мы обнаружили, что Kir2.1 деградация была нарушена в MEF как Atg7 KO , так и Atg5 KO , это указывает на то, что для наблюдаемого нами фенотипа необходимы дополнительные гены, связанные с аутофагией. Тем не менее, морфологические и синаптические дефициты, наблюдаемые в dSPN Atg7cKO , могут возникать из-за независимой от аутофагии роли Atg7 и, более того, деградация Kir2 может происходить посредством независимых от аутофагии, но зависимых от Atg5 и Atg7 процессов. Как предполагает рецензент, мы изменили язык в нашей рукописи, чтобы подчеркнуть, что мы обращаемся к роли Atg7 в этой нейрональной популяции, и что это может влиять на дополнительные клеточные процессы помимо аутофагии.Мы добавили три раздела в раздел «Обсуждение», которые касаются этого вопроса следующим образом: Мы добавили раздел в Обсуждение, повышающий вероятность того, что наблюдаемые фенотипы не опосредуются аутофагией как таковой: «Atg7 также участвует в неаутофагических процессах, таких как LC3-ассоциированный фагоцитоз и секреция лизосомного содержимого (Subramani and Malhotra, 2013). Возможно, что Atg7 вносит вклад в морфологию дендритов dSPN и синаптические входы посредством этих процессов в противоположность «классической» аутофагической деградации.Дальнейшее понимание могут дать будущие исследования, сравнивающие потерю других связанных с аутофагией генов, которые не вносят вклад в связанный с LC3 фагоцитоз или лизосомный экзоцитоз ». Мы также включили расширенный раздел в раздел «Обсуждение» о специфических различиях клеточного типа в деградации Kir2, наблюдаемой в полосатом теле: «В отличие от iSPN, количество Kir2.1 и Kir2.3 и токи Kir2 не были затронуты потерей аутофагии у мышей dSPN Atg7cKO . Поскольку каналы Kir2 экспрессируются в обеих популяциях SPN и играют важную роль в физиологии как dSPN, так и iSPN (Cazorla et al., 2012; Gertler et al., 2008; Либерман и др., 2018; Shen et al., 2007), эти данные подтверждают, что деградация каналов Kir2 с помощью аутофагии происходит посредством механизмов, специфичных для типа клеток. Эта специфичность клеточного типа может возникать из-за дифференциальной экспрессии грузовых адаптеров, посттрансляционной модификации каналов Kir2, которые нацелены на них для аутофагической деградации, или повышенной активности альтернативных путей деградации эндолизосомных белков, которые вносят вклад в деградацию Kir2 в кардиомиоцитах (Ambrosini et al., 2014; Янсен и др., 2008; Колб и др., 2014). Дальнейшая работа будет сосредоточена на механизме, который придает специфичность клеточного типа аутофагической деградации каналов Kir2 ». Наконец, мы добавили параграф в раздел «Обсуждение», в котором излагаются доказательства нашего вывода о том, что Atg7 необходим для аутофагической деградации каналов Kir2: «Было высказано предположение, что гены, связанные с аутофагией, такие как Atg5 и Atg7, играют роль в других клеточных процессах, таких как связанный с LC3 фагоцитоз, лизосомный экзоцитоз и эндоцитоз (Subramani and Malhotra, 2013).Здесь мы утверждаем, что Kir2.1 является прямым субстратом аутофагии по следующим причинам. Во-первых, деградация Kir2.1 отсутствует в MEF как Atg5 KO , так и Atg7 KO . Дополнительные исследования на клетках, лишенных других необходимых белков аутофагии, таких как Fip200, дополнительно подтвердили бы эту гипотезу. Во-вторых, мы продемонстрировали прямую совместную локализацию с везикулами LC3 + и что количество Kir2.1 в везикулах LC3 + увеличивается в ответ на блокаду слияния аутофагосом и лизосом.Наконец, интернализация Kir2.1, измеренная с помощью анализов питания антителами, не затрагивается в MEFs Atg5 KO , что свидетельствует против роли Atg5 в эндоцитозе Kir2.1. В совокупности эти данные показывают, что Kir2.1 должен пройти через зависимую от аутофагии органеллу, предположительно амфисому, прежде чем подвергнуться лизосомной деградации ».
Мы благодарим рецензентов за указание на это. Мы согласны с тем, что наши данные предлагают модель, в которой большая часть каналов Kir2 будет ацетилирована в iSPNs или MEFs, лишенных аутофагии.Мы предполагаем, что каналы Kir2 должны быть ацетилированы, чтобы подвергнуться аутофагической деградации, и что этот процесс протекает неконтролируемым образом в iSPNs или MEFs, лишенных аутофагии, поскольку ацетилированный канал больше не деградируется аутофагией или деацетилируется в органеллах, зависимых от аутофагии. Хотя эта модель объясняет данные, которые мы представляем в этой рукописи, существуют альтернативные возможности, которые мы не исключаем. Например, Kir2.1 может быть неспособен взаимодействовать с требуемым кофактором в MEF Atg5 KO или iSPN без Atg7.В качестве альтернативы, мы не можем исключить изменения в локализации Kir2, которые наши методы были недостаточно чувствительны для обнаружения. Чтобы рассмотреть эти альтернативные механизмы ингибирования Kir2.1, мы провели дополнительные эксперименты и добавили параграф в раздел «Обсуждение». Во-первых, мы измерили эффект увеличения уровней PIP2 в iSPN, лишенных аутофагии. PIP2 является необходимым липидным кофактором для активности Kir2. Чтобы выяснить, снижается ли это взаимодействие в iSPN, лишенных аутофагии, мы включили diC8-PIP2, водорастворимый аналог PIP2, которого достаточно для восстановления пониженной активности Kir2 в других моделях гипервозбудимости SPN (Lieberman et al., 2018) к нашему внутреннему решению, но не обнаружил влияния на токи Kir2 (изображение ответа автора 4). В клетках WT diC8-PIP2 не влияет на токи Kir2, поскольку сайт связывания PIP2 на каналах Kir2 составляет насыщен в исходных условиях (Logothetis et al., 2007; Xie et al., 2008). Напротив, если снижение связывания PIP2 с Kir2 было ответственным за ингибирование Kir2 в клетках с дефицитом аутофагии, diC8-PIP2 д. Увеличивать токи Kir2. Отсутствие эффекта diC8-PIP2 на iSPNs с дефицитом аутофагии указывает на то, что потеря аутофагии не влияет на взаимодействие Kir2 с PIP2.Мы решили не включать это в исправленную рукопись, поскольку это не было частью исчерпывающей характеристики взаимодействия Kir2, но можем включить ее, если рецензенты твердо уверены, что она должна быть частью данной рукописи. Повышение клеточного уровня PIP2 не спасает токи Kir2 в Atg7-дефицитных iSPN. ( A ) diC8-PIP2 (50 мкМ) был включен во внутриклеточный раствор.Процентное изменение токов Kir2 после 12 минут диализа внутренним раствором ((Lieberman et al., 2018). Никакого эффекта diC8-PIP2 не обнаружено ни для одного из генотипов. Данные проанализированы с помощью двухфакторного дисперсионного анализа с последующим тестом Бонферрони. Генотип x PIP2: F (1,29) = 1,124, p = 0,2978; Генотип: F (1,29) = 0,8626, p = 0,3607; PIP2: F (1,29) = 0,03962, p = 0,8436 . Каждое заболевание возникло у более чем 3 мышей. Во-вторых, мы провели эксперименты, направленные на понимание того, влияет ли ацетилирование на место жительства Kir2 на поверхности или вместо этого влияет на функцию каналов на поверхности (Рисунок 8 — Рисунок Дополнение 1).Мы количественно определили поверхностные уровни WT, K334R и K334Q Kir2.1 в MEF Atg5WT и AtgKO. В этом эксперименте мы воспроизвели повышенные поверхностные уровни Kir2.1 WT в Atg5KO по сравнению с MEF Atg5WT. Однако поверхностные уровни мутантов K334R и K334Q не отличались от WT Kir2.1 в MEF Atg5WT или Atg5KO. Эти данные предоставляют дополнительное механистическое понимание того, как статус ацетилирования Kir2.1 по K334 может влиять на активность канала Kir2: он д. Делать это путем регулирования функции на поверхности, а не контроля пребывания на поверхности.Будущие исследования, направленные на определение биофизического механизма ингибирования канала Kir2 в этой системе, являются оправданными. Мы добавили в Обсуждение дополнительный раздел, в котором перечисляем альтернативы предлагаемой нами модели: «Несколько альтернативных моделей могут объяснить наши данные, включая снижение уровня необходимого кофактора для Kir2 в клетках с дефицитом аутофагии и изменения в локализации мембраны, которые ниже предела обнаружения наших подходов. Дальнейшее изучение взаимодействия Kir2 в клетках дикого типа и клетках с дефицитом аутофагии может пролить свет на эти механизмы.”
Деградация канала Kir2 не была изучена подробно в других нейронах ЦНС. Однако в кардиомиоцитах убедительные доказательства подтверждают роль лизосомной деградации, но неясно, происходит ли это после аутофагии как таковой и / или других путей эндосомальной деградации.Дополнительные эксперименты, сравнивающие обработку каналов Kir2 в др. Популяциях нейронов, д. Бы понять эти процессы. Что касается отсутствия накопления Kir2 у мышей dSPN Atg7cKO , мы не считаем, что это влияет на наш вывод о том, что в iSPN (и в культивируемых MEF) Kir2 разлагается посредством Atg5 / 7-зависимого процесса (называемого здесь как аутофагия). Доказательства аутофагической деградации Kir2 следующие: (1) деградация Kir2 зависит от Atg7 и Atg5 в MEF и от Atg7 в iSPN; (2) Kir2.1 локализуется в компартменте LC3 + Atg5-зависимым образом в MEFs; (3) повышение pH лизосом путем обработки клеток бафиломицином увеличивает локализацию Kir2.1 в компартменте LC3 +. В dSPN должны быть альтернативные механизмы деградации Kir2. Например, в кардиомиоцитах каналы Kir2 могут разрушаться с помощью альтернативных эндолизосомных механизмов, хотя взаимодействие между Kir2 и аутофагией официально не исследовалось в сердце (Ambrosini et al., 2014; Jansen et al., 2008; Колб и др., 2014). На молекулярном уровне различия в локализации, экспрессии или активности (еще не идентифицированной) ацетилтрансферазы, необходимой для деградации Kir2 в некоторых типах клеток, могут не вести Kir2 к аутофагической деградации в dSPNs. Альтернативно (пока не идентифицированный) адаптерный белок, который рекрутирует Kir2 на Atg7-зависимый аутофагический промежуточный продукт, также может дифференциально экспрессироваться в dSPN. Наконец, мы отмечаем, что отсутствие накопления Kir2 в dSPN Atg7cKO может не означать, что Kir2 не разлагается аутофагией в базальных условиях, но вместо этого может предполагать, что dSPN, но не iSPN, обладают компенсаторным механизмом, который активируется в отсутствие аутофагии и предотвратить накопление Kir2.Постоянные усилия в нашей лаборатории направлены на определение молекулярных механизмов, которые способствуют аутофагической деградации Kir2, и их идентификация приведет к новым гипотезам о разнице между трафиком Kir2 в dSPN и iSPN. Мы включили новый абзац в раздел «Обсуждение», в котором размышляют о возможных механизмах специфической для клеточного типа деградации Kir2.1, как показано выше в ответ на пункт 4 интерпретации.
Мы благодарим рецензента за указание на эту статью и приносим свои извинения за упущение. Теперь мы цитируем эту статью во Введении при описании роли аутофагии в нейротрансмиссии. Обратите внимание, что это исследование не показало снижения передачи дофамина в полосатом теле, поскольку они рассекли полосатое тело и измерили содержание дофамина с помощью ВЭЖХ, а не высвобождение передатчика.
Литература относительно различий между морфологией dSPN и iSPN противоречива. Хотя Gertler и Surmeier (Gertler et al., 2008) сообщают о различиях в длине дендритов между подтипами SPN, другие не находят различий (Cepeda et al., 2008; Suárez et al., 2014). В наших данных мы не видим четкой разницы в общей длине дендритов или сложности дендритов между контрольными dSPN и iSPN; Однако отметим, что это не было заранее запланированным сравнением. Мы добавили предложение в раздел «Обсуждение», в котором отмечаем это различие, которое существует в литературе: «Хотя мы не наблюдали разницы между дендритной морфологией dSPN и iSPN, существуют противоречивые сообщения о морфологических различиях между dSPN и iSPN (Cepeda et al., 2008; Gertler et al., 2008; Suárez et al., 2014). Будущие исследования должны быть нацелены на согласование этих разрозненных результатов ». Больше проблем, репрезентативные (лучшие трассы?) Очень прерывистые / шумные, особенно для записи срезов, где базовые линии обычно очень чистые. Это вызывает беспокойство, потому что средние амплитуды mEPSC и mIPSC выходят на уровне 5-7 пА, меня беспокоит, что было включено в эти данные (каковы Ra и IRMS для этих записей?). Вызванные токи на Рисунке S2 C, должны быть показаны сгруппированные данные, а не наложенные кривые; более того, для этого недостаточно n, равного 7, такие числа могут быть достигнуты при приготовлении препарата за один день / мышь. Что касается mEPSC и mIPSC, мы приносим свои извинения за то, как образцы трассировок были отрисованы на Рисунке 2 из исходной заявки. Мы заменили соответствующие образцы трассировок на Рисунке 3 исправленной заявки. Среднеквадратичный шум на буровой установке, на которой были собраны эти данные, постоянно находится в пределах 1,5–2,5 пА. Медианные амплитуды mEPSC в наших записях составляют ~ 10 пА, что> 3x среднеквадратичного шума. Последовательное сопротивление отслеживалось в режиме онлайн как до, так и после записанных эпох, в которых измерялись mEPSC или mIPSC.Если последовательное сопротивление было> 25 МОм или изменилось на> 20%, ячейки исключались. Эти критерии четко изложены в разделе «Материалы и методы» оригинальной и исправленной рукописей. Кроме того, мы проанализировали данные с помощью специального скрипта Igor, который был опубликован и неоднократно использовался нашей лабораторией и другими (Mosharov and Sulzer, 2005). Пики обнаруживаются с использованием первой производной кривой, а амплитуда вызванных пиков должна тогда превышать определенное пользователем число стандартных отклонений (SD) среднеквадратичного шума.Пороговые значения SD были установлены как 4x для mEPSC и 3x для mIPSC, как описано в разделе методов. Таким образом, мы уверены, что наши данные mEPSC и mIPSC содержат соответствующую информацию, которая подтверждает выводы из рисунка 3 исправленной рукописи. Что касается вызванных EPSC, согласно предложению рецензентов ниже, мы удалили кривые ввода / вывода, изначально показанные на Рисунке S2 исходной заявки. Тем не менее, мы подчеркиваем, что, как указано в разделе «Материалы и методы»: все данные электрофизиологии были получены по крайней мере от 3 мышей (обычно 4-5 мышей), и все эксперименты с культурами клеток были независимо воспроизведены по крайней мере в трех отдельных экспериментах.
Мы благодарим рецензента за указание на несоответствия в наших ссылках на разные фракции из эксперимента фракционирования. Мы отмечаем, что мы использовали два подхода к ортогональному фракционированию, и, таким образом, терминология различается между экспериментом по фракционированию на Рисунке 6 и на Рисунке 6 — приложение к рисунку 1. Мы получили изображения вестерн-блотов на рисунке 5 — приложение 2, рисунок 7 — приложение 1, рисунок 7, рисунок 8 и рисунок 8 — приложение 1 на Azure Biosystems C600 с настройками по умолчанию.Помимо обрезки изображений, чтобы выделить соответствующую полосу в пятне, не было выполнено ни редактирования изображений, ни сшивания. Три белые диагональные линии, упомянутые рецензентом, присутствуют на исходном изображении с машины Azure. Вестерн-блоты на других рисунках были получены с использованием пленки и оцифрованы с помощью сканера или системы LICOR Odyssey и не имеют этого артефакта. Мы включаем полноразмерные блоты для всех вестерн-блотов в дополнительные файлы.
Чтобы выяснить, является ли Kir2.1 K334R менее ацетилированным, чем канал WT, мы иммунопреципитировали WT или K334R Kir2.1 из MEF Atg5 KO и провели иммуноблоттинг на остатки ацетиллизина и Flag, как показано на рисунке 7A. Мы обнаружили примерно 50% снижение ацетилирования на Kir2.1 K334R по сравнению с каналом WT в MEF Atg5 KO и включили эти данные в Рисунок 7 — приложение к рисунку 1.Мы пришли к выводу, что Kir2.1 ацетилирован по нескольким остаткам, но что мутант K334R значительно снижает общее ацетилирование канала. Мы попытались выделить ацетилированный Kir2.1 или Kir2.3 из полосатого тела мыши, но не смогли успешно иммунопреципитировать канал доступными антителами против эндогенного белка. Кроме того, в литературе нет сообщений об иммунопреципитации эндогенного канала Kir2 из мозга мыши.
Мы благодарим рецензентов за эти комментарии. Мы решаем их индивидуально. 1) Хотя ось y начинается выше нуля, более четко отображаются относительные различия между группами на рисунках 1A и 1E (рисунок 1 исходной заявки, рисунок 2 исправленной заявки), особенно учитывая, что ни одна мышь не весила менее 15 г, мы изменили ось Y для обеих панелей, чтобы она начиналась с нуля. 2) Эффективность Rotarod действительно имеет значительную обратную корреляцию с массой тела (McFadyen et al., 2003). Мы согласны с тем, что это может указывать на то, что мыши dSPN Atg7cKO могут работать с вращающимся стержнем хуже, чем мыши iSPN Atg7cKO , потому что их латентность падения была аналогичной, но они весили значительно меньше. Мы добавили предложение к результатам, касающееся этой возможности. «Мы отмечаем, что между мышами dSPN Atg7cKO и iSPN Atg7cKO могут существовать различия в моторном обучении, поскольку тест вращающегося стержня очень чувствителен к массе тела (McFadyen et al., 2003) и мыши dSPN Atg7cKO весят значительно меньше, чем мышей iSPN Atg7cKO (рис. 2A) ». 3) Мы согласны с тем, что одна возможная интересная особенность этого эксперимента заключается в том, что мыши dSPN Atg7cKO , в отличие от мышей iSPN Atg7cKO , по-видимому, улучшили свою производительность в трех испытаниях, что позволяет предположить, что они лучше усваивают задание. Чтобы проверить это, мы сравнили разницу в латентности падения между испытанием 1 и испытанием 3 в контроле, мышах dSPN Atg7cKO и iSPN Atg7cKO (изображение ответа автора 5).Мы обнаружили, что обучение существенно не различается у контрольных мышей и мышей dSPN Atg7cKO , но было значительно хуже у мышей iSPN Atg7cKO . Не было существенной разницы между обучением мышей dSPN Atg7cKO и мышей iSPN Atg7cKO . Поэтому мы решили не включать в рукопись заявление о различиях в обучении двух мышей с условным нокаутом. Различия в моторном обучении между контрольными мышами dSPNAtg7cKO и iSPN Atg7cKO . Разница в латентности падения между испытанием 3 и испытанием 1 была нанесена на график для каждой мыши, представленной на рисунке 2B. Данные анализировали с помощью однофакторного дисперсионного анализа с последующим апостериорным тестом Бонферрони.
Антитела Kir2.1 и Kir2.3, использованные в этом исследовании, использовались в литературе в отношении мозга мышей, в частности, в лизатах полосатого тела (Cazorla et al., 2012; Lieberman et al., 2018). Как и предполагалось, мы проверили антитело Kir2.1, используя наши варианты с меткой Flag в MEF (изображение ответа автора 6). Мы обнаружили, что антитело Kir2.1 обнаруживает полосу правильного размера (~ 75 кДа; Kir2.1 + тег Flag + тег SNAP) в MEF Atg5 WT и Atg5 KO , трансфицированных этой конструкцией, но не обнаруживает группа в нетрансфицированных сестринских культурах.Эта полоса также была обнаружена антителом Anti-Flag. Обратите внимание также на увеличение p62 в MEF Atg5KO и на то, что антитело против Kir2.3 не обнаруживает полосу ни в одном из лизатов. Этот эксперимент был повторен 4 раза. Специфичность антитела Kir2.1.лизатов получали из MEF Atg5 WT и Atg5 KO с трансфекцией Kir2 или без нее.1 FlagSNAP и промокнул для Flag, Kir2.1, Kir2.3, p62 и актина.
Драйверные линии D1cre (eye262) и A2Acre (KG139) были ранее охарактеризованы и широко используются в исследовании различных типов стриатальных клеток, и мы решили охарактеризовать эффективность и специфичность Cre-опосредованной рекомбинации «floxed» Аллель Atg7 в этих моделях животных.Чтобы повысить уверенность в нашем анализе, мы выполнили иммуногистохимию на 3 дополнительных контрольных мышах (Atg7 Fl / Fl D1T), 3 дополнительных мышах dSPNAtg7 cKO (D1cre Atg7 Fl / Fl D1T) и 1 дополнительном iSPNAtg7 cKO мышь (A2Acre Atg7 Fl / Fl D1T). Мы объединили эти данные с данными из исходной заявки на рисунке 1 — рисунок в приложении 1 (см. Обсуждение выше). Мы обнаружили, что ~ 75-80% dSPN имеют «агрегаты» p62, что является показателем потери аутофагии (Klionsky et al., 2016; Komatsu et al., 2007; Tang et al., 2014). Кроме того, мы обнаружили, что примерно 15% клеток p62 + являются D1-отрицательными (предполагаемые iSPN). Хотя это говорит о том, что Cre-опосредованная рекомбинация в этой линии не на 100% эффективна и имеет некоторую неспецифическую рекомбинацию, эти числа аналогичны существующим сообщениям в литературе и дают нам уверенность в том, что эти животные модели позволяют нам изучить роль аутофагия в физиологии dSPN.
Мы согласны с тем, что увеличение количества животных в нашем анализе повысит нашу уверенность в выводах. Чтобы решить эту проблему, мы сгенерировали дополнительные когорты мышей dSPN Atg7cKO и мышей iSPN Atg7cKO и соответствующих контрольных однопометников. Эти новые когорты включали 15 контрольных (9 самцов и 6 самок), 11 мышей dSPN Atg7cKO (7 самцов и 3 самки) и 10 мышей iSPN Atg7cKO (5 самцов и 5 самок).После добавления данных из этой когорты к нашему анализу (включая данные из исходной заявки) мы снова не обнаружили взаимодействия между полом и генотипом после двухфакторного дисперсионного анализа, предполагая, что в нашем окончательном анализе целесообразно объединить мужчин и женщин. Для полноты, как и в исходной рукописи, мы включили все данные этих поведенческих экспериментов в Таблицу 1, разделив их как по полу, так и по генотипу. Мы надеемся, что эта дополнительная когорта мышей удовлетворит опасения обозревателей по поводу строгости поведенческих экспериментов.
Мы благодарим рецензентов за эти комментарии. В первоначальном представлении мы указали N для наших электрофизиологических экспериментов следующим образом: мы указали количество клеток в наших электрофизиологических анализах на гистограммах (с отдельными точками, представляющими отдельные клетки).Для ясности условных обозначений фигур (как это предлагается в руководстве для авторов на веб-сайте eLife ) мы включили количество животных для каждой группы в дополнительную таблицу вместе с подробной информацией о статистических тестах. Чтобы ответить на точку зрения рецензентов, мы выбрали двусторонний подход. Во-первых, мы включили записи от 13 дополнительных мышей (> 60 дополнительных клеток), увеличив количество клеток, записанных и реконструированных на рисунке 3, и количество клеток, записанных от мышей с вирусными инъекциями, на рисунке 6.Во всех экспериментах зарегистрированные клетки были получены как минимум от 4 мышей. Во-вторых, мы явно включили количество клеток и количество животных, использованные статистические и статистические критерии t или F, а также точные значения p в подписи к рисункам. Мы сохранили Таблицу 2 с подробной информацией о среднем значении и ошибке для каждого наблюдения, количестве клеток и мышей, используемом статистическом тесте, значении t или F (в зависимости от случая) и значении p на рисунке 3, поскольку эта легенда к рисунку неуправляема. когда эта информация включена, и добавили предложение в раздел результатов рукописи, подчеркивающее наличие этого ресурса.Мы надеемся, что эти изменения укрепят доверие рецензентов и редакторов к этим выводам.
Мы благодарим рецензента за этот комментарий и удалили данные о вызванных EPSC (eEPSC) из дополнительных данных. Однако мы хотели бы подчеркнуть, что мы видим задержку в 510 мс для наших записанных eEPSC, и они блокируются NBQX, антагонистом AMPAR, подтверждая вывод о том, что это синаптически вызванные ответы.
Чтобы решить эту проблему, мы получили лизаты полосатого тела из 28 дополнительных мышей (14 контрольных, 7 dSPN Atg7cKO и 7 iSPN Atg7cKO ) и провели блоттинг на Kir2.1, Kir2.3, p62, Kv1.2, PSD95 и актин. Новые данные включены в рисунок 5 и рисунок 5 — дополнение к рисунку 1. Заключение не было изменено. https://doi.org/10.7554/eLife.50843.sa2 Маленькие мисс Возбуждающие и мистер Наив: знакомьтесь с различными «клеточными состояниями»Они воодушевляются. Иногда они немного болтливы. И они известны своей наивностью.Мы не описываем обычного подростка, а скорее говорим о наших клетках, строительных блоках жизни. Нас примерно 37 триллионов. И среди этого огромного мегаполиса клеточного вещества есть около 210 различных типов клеток, от лимфоцитов до бета-клеток и заканчивая более описательно названными клетками люстры и колеса телеги (два типа нейронов).Клетки также выполняют ряд важнейших действий, от преобразования питательных веществ в энергию до передачи электрических сигналов через свои мембраны. Наши клетки не только демонстрируют широкий спектр особенностей, но и обладают красочными «личностями» или клеточными состояниями, назначенными им учеными, которые исследуют и систематизируют человеческое тело на самом фундаментальном уровне. Вот несколько самых интригующих сотовых «персонажей». Маленькая мисс «Возбуждаемая»
В отличие от малыша, радостно подпрыгивающего, заметив любимого мультяшного персонажа, «возбудимость» в клетках относится к способности мышц, нервов и клеток поджелудочной железы. быстро реагировать на раздражители и передавать электрические заряды.Уникальность этих клеток заключается в том, что они имеют пористые и высокочувствительные мембраны, которые могут обнаруживать небольшие химические изменения в окружающей их среде и соответствующим образом реагировать. Все клетки обладают потенциалом покоя, разницей в электрическом заряде внутри и снаружи клеточной мембраны. Но возбудимые клетки при стимуляции могут передавать электрические импульсы, которые приводят к различным процессам, включая отправку информации в другие части мозга для создания мыслей, заставляющих сердце биться; и секретирование инсулина. Маленький мистер «Недифференцированный»
Подобно первокурснику колледжа, который еще не определился со своей специальностью (английская литература или машиностроение?), Недифференцированная ячейка еще не выбрала специальность. Но посредством процесса, известного как дифференциация, который контролируется нашими генами, эти клетки превращаются в различные специализированные типы клеток в нашем организме. Самые первые клетки эмбриона считаются недифференцированными. Маленькая мисс«Наивный»
Ой, быть молодым и наивным и никогда раньше не сталкиваться с противником. Так обстоит дело с наивными Т-клетками, иммунными клетками, которые вновь создаются в костном мозге и еще не подвергаются воздействию патогена. Когда наивные клетки попадают в тимус, орган грудной клетки, они превращаются в зрелые клетки, приобретая уникальный антиген или «замок» на его поверхности, который может распознавать чужеродных захватчиков. Маленький мистер Болтун — a.k.а. «Talkative Cells»
Почти все клетки общаются на языке химических сигналов, таких как гормоны и нейротрансмиттеры. У каждой клетки есть рецепторы, похожие на «уши», которые могут улавливать эти сигналы. Но некоторые, как правило, немного болтливее, чем другие. К числу самых «болтливых» клеток относятся нейроны мозга, которые посылают сигналы, которые помогают нам думать и усваивать новую информацию. В раковых клетках слишком много «разговоров» между соседними здоровыми клетками на самом деле может помочь стимулировать рост опухоли.Ученые ищут способы лечения рака, побуждая здоровые клетки посылать сигналы, чтобы остановить рост раковых клеток. Призрачные клеткиВерите ли вы в сверхъестественных духов или нет, в наших клетках есть свои версии призрачных призраков. На протяжении десятилетий ученые пытались лучше разгадать тайну «клеток-призраков», клеток, которые имеют очертания внешней мембраны, но не имеют ядра и цитоплазмы. Призрачные клетки были впервые обнаружены в доброкачественных опухолях кожи и кистах челюсти.Красные кровяные тельца также могут превращаться в призраков. Когда эритроцит вытесняет свой гемоглобин из-за травмы или болезни, он становится более бледной версией самого себя, известной как призрачный эритроцит. Наши тела содержат множество клеток с разными «личностями», которые работают согласованно. И, как и в любой сложной системе, для бесперебойной работы требуются все типы. исследование возбудимых клетокНейрональная электрофизиология (ephys) — это исследование электрических свойств биологических клеток и тканей нервной системы.Изменения этих свойств позволяют нервной системе выполнять свои многочисленные функции, которые не только отвечают за поддержание нашей жизни, но также позволяют нам достичь более высоких уровней сознания. Ephys включает измерения этих изменений, обычно напряжения или тока, в различных масштабах от отдельных ионных каналов до всего мозга. Изучение этих свойств имеет много значений, выходящих за рамки базового понимания того, как работает мозг, включая исследования неврологических расстройств и потенциального использования или воздействия фармацевтических соединений. Большой потенциалЭлектрические потенциалы на клеточных мембранах (и их вариации) — вот что делает некоторые клетки электрогенными. Они создаются путем поддержания различных концентраций ионов, таких как натрий (Na + ) и калий (K + ), между внутренней частью клетки (внутриклеточная жидкость) и снаружи (внеклеточная жидкость). Мембрана клетки предотвращает движение ионов через нее. Единственный способ, которым они могут диффундировать, — это проходить через специализированные ионные каналы, которые могут быть открытыми или закрытыми. Когда нейрон находится в состоянии покоя, большинство каналов Na + закрыто, но несколько каналов K + открыты. Ионы K + могут свободно диффундировать из ячейки вниз по градиенту концентрации, в то время как электрическая сила, создаваемая ионами K + , притянутыми к внутренней части отрицательной ячейки, втягивает ионы K + в ячейку. Эти силы будут обеспечивать равновесие, при котором нет чистого движения ионов K + через мембрану. Это равновесный потенциал для K + .Мембранный потенциал покоя представляет собой сумму равновесных потенциалов всех ионов и их относительной проницаемости. В нейронах это приводит к заряду через мембрану от -60 до -70 мВ. Эта анимация дает отличное визуальное представление о том, как нейроны создают мембранный потенциал покоя. Потенциалы действия возникают в нейронах после того, как они стимулируются сенсорными или электрическими сигналами. Этот вход может быть гиперполяризационным или деполяризующим. Если ток деполяризации достигает определенного порога, возникает потенциал действия.Потенциалы действия — это события «все или ничего»; амплитуда не меняется в зависимости от размера предыдущего стимула. Срабатывание потенциалов действия в режиме записи токовых клещей Возбуждение нейрона обусловлено открытием все большего числа потенциалзависимых натриевых каналов и проникновением ионов Na + в клетку. После возникновения потенциала действия клеточная мембрана быстро реполяризуется до своего мембранного потенциала покоя. Эта анимация дает более подробную информацию о процессе возникновения потенциалов действия. Потенциалы действия распространяются по аксону для доставки электрических сигналов в другие части клетки. Направленный внутрь ток в одной точке аксона распространяется вдоль аксона и деполяризует соседние участки мембраны. Мембранным участкам нужно время для восстановления после срабатывания, прежде чем может проявиться еще один потенциал действия. Это ограничивает частоту срабатывания потенциала действия, но также гарантирует, что он может перемещаться только в одном направлении вдоль аксона. Записи внутриклеточных и патч-зажимовЧтобы изучить эти потенциалы, электрофизиологи делают различные записи. Традиционные внутриклеточные записи требуют введения микроэлектрода внутрь клетки. Большинство электродов имеют форму стеклянной микропипетки с наконечником <1 мм. Эти пипетки наполнены раствором внутриклеточной жидкости (аналогично жидкости в ячейке). Проволока из хлористого серебра внутри пипетки соединяет этот раствор с усилителем, который может записывать и обрабатывать этот сигнал. Метод патч-зажима устраняет необходимость проталкивать клетку, и вместо этого пипетка помещается на «заплатку» мембраны.Микропипетки с патч-зажимом часто имеют немного больший диаметр и размещаются рядом с ячейкой. Мягкое всасывание втягивает часть мембраны в наконечник, создавая ситуацию, известную как режим прикрепления клеток. Режим привязки к клетке можно использовать для измерения электрических свойств ионных каналов в этом конкретном участке мембраны (технически это не форма внутриклеточной записи). (Источник: Allen Institute for Brain Science) Применение большего всасывания может привести к разрыву пластыря, в результате чего электрод будет контактировать с цельной клеткой, отсюда и название режим цельной клетки.Это позволяет делать стабильные внутриклеточные записи. Существуют и другие способы зажима патч-зажимов, включая вывернутые, наружно-наружные, перфорированные и свободные. Каждый из этих режимов позволяет изучать несколько разные свойства ионных каналов внутри мембраны. Это видео дает отличный обзор техники патч-кламп и ее различных вариаций. Метод фиксации напряжения позволяет электрофизиологам измерять изменения ионных токов через клеточные мембраны.Для этого требуется усилитель, который удерживает или «фиксирует» мембранное напряжение на заданном уровне. Это достигается путем итеративного измерения мембранного потенциала и изменения силы тока для поддержания напряжения на желаемом уровне. Токи регистрируются и показывают, как изменения потенциала влияют на клетку, что представляет особый интерес, потому что многие ионные каналы в мембране нейрона открываются и закрываются в зависимости от напряжения. Эта анимация дает визуальное описание того, как работает метод фиксации напряжения. Метод токового зажима позволяет исследователю регистрировать мембранный потенциал при подаче положительного или отрицательного тока в ячейку. В режиме токового зажима напряжение на мембране может изменяться. Изменения напряжения в ответ на введение лекарственного средства или раздражителя указывают на различия в ионной проводимости мембраны. Внеклеточные записи и массивы микроэлектродовВнутриклеточные записи отлично подходят для измерения ионных условий в отдельной ячейке.Другой набор измерений может смотреть на изменения концентрации ионов во внеклеточной жидкости или в группе нейронов. Внеклеточные записи показывают изменения тока или потенциала нескольких клеток, окружающих микроэлектрод. Изменения положения и размера этого электрода изменят характер измерения в зависимости от исследуемых свойств. Используя два или более электродов и процесс, называемый сортировкой спайков, можно определить количество регистрируемых клеток и активность, происходящую в каждой ячейке.Сортировка спайков использует компьютерные алгоритмы для анализа форм сигналов электрической активности от нескольких электродов и различения активности отдельных нейронов. Потенциалы внеклеточного поля измеряют электрический потенциал группы клеток, источник которых трудно определить. Сигналы от этих клеток будут перекрываться, и запись будет представлять собой сумму всей электрической активности. Эти записи известны как потенциалы локального поля. Матрицы микроэлектродов — это микросхемы, которые содержат несколько электродов, через которые можно записывать нейронные сигналы.У них обычно есть стимулирующие электроды, которые также доставляют сигналы к образцу. Количество электродов варьируется от десятков до тысяч в зависимости от пространственного разрешения и количества данных, необходимых для эксперимента. Различные типы массивов могут использоваться для самых разных приложений in vitro и in vivo. Пример многоэлектродной матрицы in vitro (Источник: MultiChannel Systems) Настоящее и будущееВ настоящее время электрофизиология совершенствуется за счет комбинации с такими методами, как многофотонная микроскопия и оптогенетика. Одним из преимуществ многофотонной микроскопии является ее способность создавать подробные изображения мозга глубоко внутри мозговой ткани, что позволяет увидеть морфологию нейрона на глубинах, недостижимых с помощью стандартной флуоресцентной микроскопии. Объединив эту информацию с подробной информацией об электрической активности, исследователи могут по-новому взглянуть на структуру и функции клеток. Оптогенетика позволяет исследователям возбуждать или подавлять определенные нейроны с беспрецедентным временным и пространственным разрешением с помощью света.Регистрируя электрическую активность, окружающую нейрон, который был стимулирован или подавлен, можно установить прямую связь между возбудимостью нейронов и последствиями для связанных клеток. Дальнейшие разработки в области оптогенетики и микроскопии позволят исследователям проводить более сложные эксперименты в различных областях мозга и помогут улучшить наши знания о нервной системе. Одним из потенциальных направлений развития электрофизиологии является создание более совершенных красителей, чувствительных к напряжению.Современные красители могут использоваться для измерения электрической активности внутри клеток без использования микроэлектрода. К преимуществам чувствительных к напряжению красителей можно отнести возможность одновременного измерения на больших популяциях клеток. Это позволяет визуализировать и количественно оценить возникновение и распространение потенциала действия через нейронную сеть. Однако улучшения в том, как они функционируют, позволят сделать дальнейшие выводы. Эти улучшения включают улучшенную количественную оценку, уменьшение фармакологических эффектов и совместимость с двухфотонной визуализацией. Нейроны изучались тысячелетиями, но еще многое предстоит узнать о нервной системе и человеческом мозге. Электрофизиология — отличный способ исследовать нейронную активность в различных масштабах, и с появлением более продвинутых методов и технологий появляется еще больше возможностей для открытий. Изображение баннера Кредит: Псиракис Димитриос и Содикджон А. Кодиров . |
